Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 330 questões
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
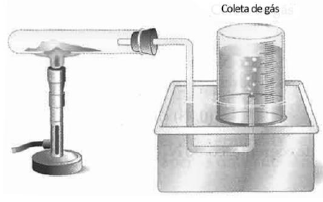
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
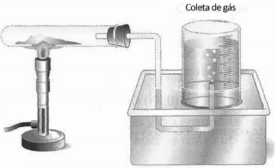
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
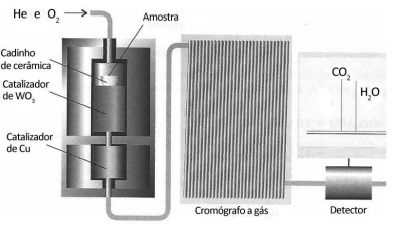
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
A velocidade média quadrática das moléculas de um gás é proporcional à raiz quadrada da temperatura e inversamente proporcional à raiz quadrada da massa molar.
Assinale a alternativa que corresponde ao significado da afirmação apresentada.
CNTP: 1 atm e 273 K R = 0,082 atm L mol-1 K-1
Considere um gás ideal que passa por uma transformação durante a qual sua pressão e o volume que ocupa podem variar, mas sua temperatura é sempre mantida constante. A Lei de Boyle-Mariotte garante que, nessas circunstâncias, o produto entre a pressão P e o volume V ocupado pelo gás é constante. Quando o gás considerado ocupa o volume correspondente a 18ml, a sua pressão é de 3 atm (atmosferas).
Se a medida do volume ocupado pelo gás for de 2,25ml, então, sua pressão, em atmosferas, medirá
Dados: C: 12 g/mol; H: 1 g/mol. Considere que o gás metano tenha comportamento ideal. R: 0,082 atm.L.mol-1.K-1.
A pressão no interior do recipiente é:
A fórmula molecular H12C4O3 apresenta como fórmula mínima e fórmula percentual H4C2O1 e H9,09%C54,54%O36,36%, respectivamente.
Se 8 g de H2 reagem com 64 g de gás O2, produzindo 72 g de H2O, então a fórmula percentual é H11,11%O88,89%
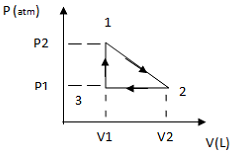
Fonte: FUNCERN, 2015
Com base nas informações do gráfico,