Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
Todas as reações explosivas produzem grande quantidade de calor. Diz-se que são altamente exotérmicas. Grandes quantidades de calor têm um efeito impressionante de aumentar o volume dos gases– quanto mais alta a temperatura, maior o volume de gás. (...) Em reações explosivas de compostos nitrados forma-se a molécula de N2, que é estável.
(LE COUTER, P e BURRESON, J. Os Botões de Napoleão, Rio de Janeiro: Zahar, 2006)
A estabilidade dessa molécula se deve :
Trinitrato de glicerina (TNG) também denominado nitroglicerina, é o éster trinitrado do propanotriol (...) O TNG é um líquido oleoso, insolúvel em água e extremamente sensível, não apenas à temperatura, mas também ao choque mecânico, motivo pelo qual deve ser manuseado com extremo cuidado. Sua combustão ao ar gera CO2, N2, O2, H2O.
(FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010.)
A combustão completa de 1 mol de TNG (Massa molecular=227g)
produz um volume de gás carbônico nas Condições Normais de
Temperatura e Pressão de
I. Não apresenta interações entre suas moléculas.
II. Em condições isotérmicas, o produto da sua pressão e do volume de uma massa deste gás é constante.
III. O volume ocupado por cada molécula é desprezível.
IV. Dado um par P e T qualquer, seu volume é conhecido.
verifica-se que
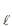 ) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.
) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.HC
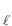 (g) + NH3(g) ? NH4 C
(g) + NH3(g) ? NH4 C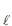 (s)
(s)Considerando-se a pressão de vapor do NH4 C
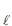 insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, é
insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, éDado: R = 0,082 atm · L · mol -1· K-1
Com base nesse princípio, considere dois balões contendo dois gases que ocupam o mesmo volume. Ambos se encontram a 25 o C e na pressão de 1 atm.
O primeiro balão contém 7,0 g de gás nitrogênio, e o segundo balão contém dióxido de carbono, sendo a sua massa, em g, igual a:
Dados:
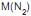 = 28 g/mol
= 28 g/mol 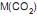 = 44 g/mol
= 44 g/mol  , etano
, etano 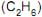 e propano
e propano 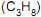 . Todos se encontram na pressão de 1 atm e a na mesma temperatura.
. Todos se encontram na pressão de 1 atm e a na mesma temperatura. Supondo os gases ideais e as suas características, considere as afirmativas abaixo.
I - O volume de oxigênio necessário para a combustão completa de todos os gases contidos nos três balões é o mesmo.
II - A densidade do etano é maior do que a do metano e menor do que a do propano.
III - A massa de propano contido num dos balões é igual à soma das massas do metano e etano contidos nos outros dois balões.
É correto APENAS o que se afirma em
Dados: C = 12; H = 1; R = 0.082 atm.L.mol -1 .K-1
I. A pressão parcial do metano é 0,6 atm.
II. A pressão total é 3,44 atm.
III. A fração em mol do butano é aproximadamente 0,5.
IV. A pressão parcial do propano é 0,615 atm.
V. A quantidade de matéria do propano é 0,11 mol.
verifica-se que estão corretas
I. A constante a está relacionada com as forças de atração intermoleculares.
II. A constante a está relacionada com o volume das moléculas fazendo com que o produto PV seja maior que o ideal.
III. A constante b está relacionada com o volume das moléculas e faz com que o produto PV seja maior que o ideal.
IV. Em pressões elevadas, os termos ( a/V ) e ( ab/ V2), que são grandezas aproximadamente iguais e de sinais opostos, podem ser ignorados na equação.
V. Em pressões elevadas, os termos bP e ( ab/ V 2) tornam-se desprezíveis. verifica-se que estão corretas
verifica-se que estão corretas
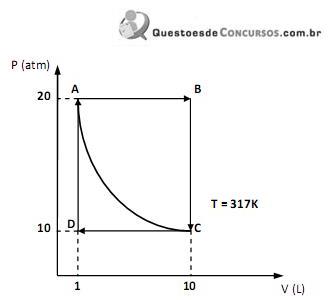
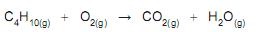
A massa de butano, em gramas, que mais se aproxima do valor que dá origem a 67,2 L de CO2 , nas condições normais de temperatura e de pressão, e considerando o comportamento de gás ideal (no qual o volume molar é igual a 22,4 L), é
Se a pressão total do sistema é de 4,5 atm, qual é a pressão parcial, considerando comportamento ideal dos gases, em atm, exercida pelo hélio nessa mistura?
Dados
M(He) = 4g/mol
M(N2) = 28g/mol
Dado: R = 0,082 atm.L.mol -1 .K-1
I. A lei dos gases ideais representada pela expressão PV= nRT pode ser usada para gases reais em baixas pressões.
II. O fator de compressão, Z, de um gás é a razão do volume molar do gás e o volume molar de um gás ideal nas mesmas condições. Portanto um gás ideal deveria apresentar Z=0, pois não há qualquer interação entre suas moléculas.
III. A equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e repulsão intermoleculares.
IV. A equação de van der Waals é uma equação de estado aproximada de um gás real, que independente da temperatura, inclui parâmetros relacionados apenas com as forças de atração.
É(São) correta(s) apenas a(s) assertiva(s)
Se a temperatura da mistura é de 27 °C, a pressão, em atm, é, aproximadamente, de
Dados: Constante universal dos gases R = 0,082 L.atm.K−1 .mol−1 Peso atômico do hidrogênio = 1 Peso atômico do oxigênio = 16 Peso atômico do nitrogênio = 14