Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
Após uma reação química de queima, foram coletados, da câmara de combustão, os gases butano, oxigênio, dióxido de carbono, monóxido de carbono e água. Os gases foram acondicionados, sob temperatura e pressão constantes, em recipientes separados e deformáveis, cujos volumes aferidos estão especificados no quadro a seguir.
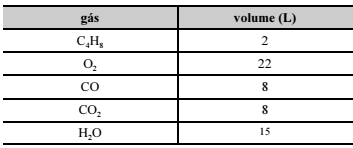
De acordo com a hipótese de Avogadro, é correto afirmar que o
número total de átomos é igual nos recipientes que contêm
Em um experimento para sintetizar o gás cloreto de hidrogênio, sob pressão e temperatura constantes, foram misturados diferentes volumes dos gases hidrogênio e cloro. Os resultados obtidos estão listados no quadro a seguir.
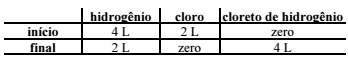
Com base nessas informações, é correto afirmar que a equação
química balanceada de preparação do cloreto de hidrogênio
corresponde a

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se uma massa fixa de gás com volume constante, é correto afirmar que o aumento da temperatura aumenta a velocidade média das moléculas e, consequentemente, o número de colisões.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que, em um cilindro, haja 7,66 kg de gás oxigênio a uma pressão de 300 bar a 25 °C e considerando-se que R = 0,082 atm.L/mol. K, M (O) = 16 g/mol, 0 °C = 273 K e 1 bar = 0,987 atm, é correto afirmar que o volume desse cilindro é de 30 litros.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
A transformação isotérmica é definida pela Lei de Boyle, segundo a qual o volume e pressão são inversamente proporcionais, mesmo quando ocorre variação na quantidade de matéria.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que a densidade dos gases pode ser definida pela sua massa molar e considerando-se que M(C) = 12 g/mol, M (O) = 16 g/mol, M (H) = 1 g/mol, M (Ar) = 40 g/mol e M(N) = 14 g/mol e que a composição do ar em volume seja de 78% de N2, 21% de O2 e 1% de Ar, é correto afirmar que os gases CO2, NH3 e CH4 são mais densos que o ar atmosférico

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se que o ar atmosférico que respiramos seja composto por CO2, O2, N2 e H2O, com 20,9% de O2, e que, no nível do mar, a pressão atmosférica seja de 760 mmHg, é correto afirmar que a pressão parcial exercida pelo O2 é de 0,209 atm.
Para determinada pressão de equilíbrio, a capacidade de armazenamento de metano em um tanque de carbono ativado aumenta gradualmente com o aumento da temperatura.
Uma massa de 2,00 g de um gás, considerado ideal, ocupa, na CNTP o volume de 2,80 L.
Esse gás pode ser o