Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
NaHCO3 + HCl → NaCl + H2O + CO2
Podemos afirmar que o grau de pureza da amostra de bicarbonato de sódio é
Um composto é formado de 92,32% de carbono e 7,68% de hidrogênio. Nas condições normais de temperatura e pressão (CNTP), 11,2 L de seu vapor pesam 39 g. A sua fórmula molecular é:
Dados: C=12 e H=1.
Dados: massas molares (g.mol -1 ), Ba=137, C=12, O=16, S=32
Dados: massas molares (g.mol -1 ),
H=1, C=12, Cl=35,5, Br=80
Dado: massa molar do Al =27g.mol -1
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
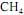 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 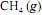 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do
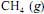 , sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
, sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de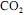 para suprir as necessidades mensais de energia da empresa.
para suprir as necessidades mensais de energia da empresa. Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol-1 e o valor da constante universal dos gases é 0,082 J.mol-1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol -1 e o valor da constante universal dos gases é 0,082 J.mol -1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
Esse gás consiste em
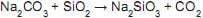
A cor do vidro muitas vezes depende das impurezas de ferro que estão presentes na areia quando o vidro é formado.
Empregando-se 1 tonelada de areia
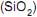 contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é
contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é 
I. soro fisiológico; II. álcool hidratado; III. vinagre; e, IV. éter etílico.
Apresentam misturas as alternativas
O volume, em litros, obtido do produto quando são consumidas 2,71x1024moléculas de Hidrogênio, nas CNTP, é igual a:
Assinale a opção que representa a relação entre o número de partículas por unidade de volume (N/V) e as coordenadas volume (V) ou pressão/temperatura (P/T) dos sistemas gasosos.
4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(g)
Considerando que a reação foi completa, é possível observar que, em um recipiente fechado, a pressão do sistema deverá
Admitindo comportamento de gases ideais, se 140 g é a quantidade máxima de gás nitrogênio (N2 ) que pode ser introduzida no primeiro cilindro, a quantidade máxima de gás metano (CH4 ), em gramas, que pode ser introduzida no segundo cilindro é