Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 330 questões
Admitindo comportamento de gases ideais, se 140 g é a quantidade máxima de gás nitrogênio (N2 ) que pode ser introduzida no primeiro cilindro, a quantidade máxima de gás metano (CH4 ), em gramas, que pode ser introduzida no segundo cilindro é
Mg(s)+ 2HCl(aq) → MgCl2(aq) + H 2(g)
A quantidade máxima de H2 obtida no experimento, em miligrama, considerando comportamento de gás ideal, é, aproximadamente, igual a:
Dados:
constante dos gases = 62,3 mmHg L K-1 mol -1
Considerando-se que o gás tem comportamento ideal, esse gás é o
Dado
RT = 24,4 atm L-1 mol -1
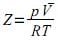
A respeito dos gases ideais e reais, assinale a alternativa CORRETA.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Considerando a ocorrência exclusiva das reações I e II, a quantidade máxima de metanol que pode ser formada a partir de uma mistura de 0,5 mol de CH4 e 1 mol de CO2 é de 0,5 mol.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

O valor da temperatura T2, representada no gráfico, é superior a 20 ºC.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Um tanque contendo metano, a 20 ºC e a 200 atm, possui maior quantidade do gás do que a quantidade estimada com a equação dos gases ideais.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando o comportamento ideal para o gás, a decomposição completa de 17,0 g de água oxigenada em H2O( l ) e O2 (g) libera um volume de O2(g), medido nas CNTP, superior a 5,0 L.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando-se condições em que o tempo de meia-vida da água oxigenada seja igual a 2 anos, é correto afirmar que em um período de 8 anos haverá a decomposição de mais de 90% da quantidade inicial de água oxigenada contida em uma solução.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

De acordo com o gráfico apresentado, a reação em questão é uma reação de primeira ordem em relação à concentração da água oxigenada.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O cloreto férrico aumenta a energia de ativação da reação, de forma que maior fração das moléculas de água oxigenada terá energia suficiente para ativar a reação.
 ) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.
) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.HC
 (g) + NH3(g) ? NH4 C
(g) + NH3(g) ? NH4 C (s)
(s)Considerando-se a pressão de vapor do NH4 C
 insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, é
insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, éDado: R = 0,082 atm · L · mol -1· K-1
Com base nesse princípio, considere dois balões contendo dois gases que ocupam o mesmo volume. Ambos se encontram a 25 o C e na pressão de 1 atm.
O primeiro balão contém 7,0 g de gás nitrogênio, e o segundo balão contém dióxido de carbono, sendo a sua massa, em g, igual a:
Dados:
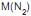 = 28 g/mol
= 28 g/mol 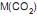 = 44 g/mol
= 44 g/mol  , etano
, etano 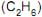 e propano
e propano 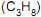 . Todos se encontram na pressão de 1 atm e a na mesma temperatura.
. Todos se encontram na pressão de 1 atm e a na mesma temperatura. Supondo os gases ideais e as suas características, considere as afirmativas abaixo.
I - O volume de oxigênio necessário para a combustão completa de todos os gases contidos nos três balões é o mesmo.
II - A densidade do etano é maior do que a do metano e menor do que a do propano.
III - A massa de propano contido num dos balões é igual à soma das massas do metano e etano contidos nos outros dois balões.
É correto APENAS o que se afirma em
A razão entre as pressões parciais do oxigênio e do nitrogênio no recipiente, considerando comportamento ideal para os gases, é aproximadamente.
Dados: R = 0,082 L atm mol -1 K-1
Quando a pressão do gás hélio é reduzida quatro vezes, o volume final do sistema, sabendo-se que NÃO houve variação na temperatura e que o gás possui um comportamento ideal, é