Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 330 questões
Uma mistura gasosa denominada de ARGOMETA P10 contém 10%, em massa, de metano e argônio em quantidade para fechar o balanço da composição. Considere que um recipiente, de volume igual a 100 L, está preenchido somente com 100 g de ARGOMETA P10.
Considerando condições ideais, a pressão parcial do metano no recipiente, em atm e a 298 K, é, aproximadamente, igual à
Dados
M (CH4 ) = 16 g mol-1
M (Ar) = 40 g mol-1
R = 0,082 atm L mol-1
K-1
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com as leis das reações gasosas de Gay Lussac,
sob mesma temperatura e pressão, o volume ocupado
pelo CO2 é maior que o volume do O2 na reação II.
Por meio do efeito Joule-Thomson, descreve-se a variação de temperatura de um gás, mantido isolado e em condições adiabáticas, ao ser forçado a passar através de uma válvula. Dependendo da temperatura e da natureza do gás, esse efeito pode resultar em aquecimento ou resfriamento, o que pode ser previsto mediante os valores do coeficiente de Joule-Thomson (μJT) e da temperatura de inversão do gás. O gráfico a seguir esboça a dependência de μJT com a temperatura para o gás hidrogênio.
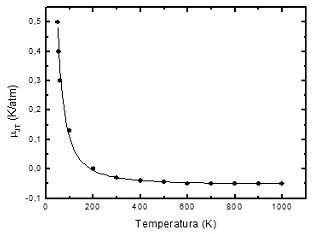
Nesse sentido, é correto afirmar que o hidrogênio, ao passar pela
válvula de uma câmara à alta pressão para outra câmara à pressão
atmosférica a 25 °C, sofrerá
Em um experimento para sintetizar o gás cloreto de hidrogênio, sob pressão e temperatura constantes, foram misturados diferentes volumes dos gases hidrogênio e cloro. Os resultados obtidos estão listados no quadro a seguir.
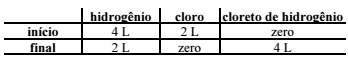
Com base nessas informações, é correto afirmar que a equação
química balanceada de preparação do cloreto de hidrogênio
corresponde a
A ureia (CO(NH2)2) é uma substância utilizada como fertilizante. Ela pode ser obtida pela reação entre o gás carbônico e amónia, conforme a equação a seguir:
CO2(g) + 2 NH3(g) → CO(NH2)2(s) + H2O(g)
Sabendo-se que 44,8 litros de amónia gasosa reagem completamente em um processo com o gás carbônico, assinale a alternativa que apresenta massa de ureia sólida obtida. (Considerar CNTP).
O carbonato de cálcio, CaCO3(s), decompõe-se com aquecimento para produzir CaO(s) e CO2(g). Uma amostra de CaCO3 é decomposta e o dióxido de carbono é coletado num frasco de 300 mL. Depois de completada a decomposição, o gás tem pressão de 1,5 atm à temperatura de 27°C. Qual é a quantidade aproximada de matéria, em mol de CO2, produzida na decomposição?
Dados:
R = 0,0821 L atm/K.mol
Massas molares (g/mol): C = 12; Ca = 40 e O = 16.
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram colocadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
A constante de equilíbrio para a dissociação de um mol ácido monoprótico em 1 litro de água é aproximadamente 1x10-5 à temperatura de 25 ºC. Se a pressão é constante, o valor aproximado da variação na energia de Gibbs (kJ mol-1) para essa reação é de
DADOS:
Constante dos gases ideais = 8,31 J K-1 mol-1 Log10 e = 0,434