Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 • mol–1
Se esse recipiente encontra-se nas condições normais de temperatura e de pressão e se a mistura for considerada uma mistura gasosa ideal, o valor da pressão parcial de amônia é, em atm, de
Considerando que os gases, nessas condições, não reagem entre si e têm comportamento ideal, a pressão total no interior do recipiente de vidro, em atm, é aproximadamente
PCl5(g) ⇌ PCl 3(g)+ Cl 2(g)
A 250oC a referida reação apresenta Kρ = 1,8. Para que a reação apresente um fator de conversão em PCl3 e Cl2 de 30%, qual a pressão aproximada que deve ser aplicada ao sistema?
A razão entre as pressões parciais do oxigênio e do nitrogênio no recipiente, considerando comportamento ideal para os gases, é aproximadamente.
Dados: R = 0,082 L atm mol -1 K-1
Quando a pressão do gás hélio é reduzida quatro vezes, o volume final do sistema, sabendo-se que NÃO houve variação na temperatura e que o gás possui um comportamento ideal, é
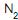 , de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de
, de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de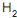 , uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de
, uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de 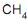 e 10% de
e 10% de 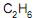 ) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é
) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é Dados: Massas molares: H = 1 kg/kmol; C = 12 kg/kmol; O = 16 kg/kmol
Considere a hipótese de reação, unicamente na direção do produto, entre 5 mol de nitrogênio gasoso e quantidade suficiente de hidrogênio gasoso para o consumo total do N2 e formação de gás amoníaco, conforme a equação a seguir.
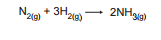
O volume máximo de NH3(g) , em litros, a ser obtido na CNTP é
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir
A percentagem de carbonato de cálcio, na amostra de calcário, considerando-se que, nas condições do experimento, o volume molar dos gases é de 25,0 L/mol e as impurezas presentes são inertes, é
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.

Considerando o comportamento ideal do gás, o volume do balão será reduzido a aproximadamente
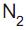 e 16 g de gás
e 16 g de gás 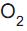 na temperatura de 27 °C.
na temperatura de 27 °C. Considerando que os gases, nessas condições, não reagem entre si e têm comportamento ideal, a pressão total no interior do recipiente de vidro, em atm, é aproximadamente
Considerando os resultados desse experimento, o metal em questão pode ser
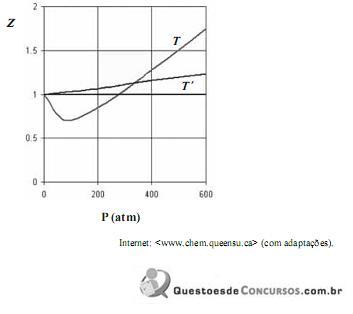
Considerando que, sob pressões elevadas, os gases deixam de apresentar comportamento ideal, e que a figura acima apresenta as curvas do coeficiente de compressibilidade (Z) para o
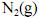 em duas temperaturas distintas (T e T’), julgue os itens subsequentes.
em duas temperaturas distintas (T e T’), julgue os itens subsequentes.À temperatura T’ e à pressão de 200 atm, o
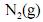 apresenta volume molar maior que o previsto pela lei dos gases ideais.
apresenta volume molar maior que o previsto pela lei dos gases ideais. 