Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
C5H12 (g) + 8 O2 (g) → 5 CO2 (g) + 6 H2O (g),
em que todos os gases estão nas mesmas condições de pressão e temperatura. Com base nessas informações, assinale a opção que corresponde ao volume de oxigênio necessário para produzir 60 m3 de gás carbônico.
Dado: R = 0,082 L atm K-1 mol -1 = 8,31 JK-1 mol -1
I – A quantidade de prata depositada na terceira cuba é 4,59 g.
II – Há produção de gás oxigênio apenas na segunda cuba.
III – A quantidade de ácido sulfúrico permanece constante na segunda cuba.
IV – O volume de oxigênio produzido, nas CNTP, na segunda cuba, é de 0,24 L.
Dado: Volume molar dos gases na CNTP = 22,4 L.mol –1
Estão corretas APENAS as afirmativas
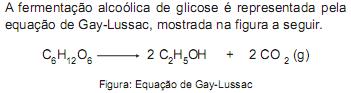
Assumindo que o gás carbônico tem comportamento ideal e que, em uma fermentação alcoólica, conduzida a 27 °C e a uma pressão de 1 atmosfera, foram gerados 2400 L desse gás, nas Condições Normais de Temperatura e Pressão (CNTP), este volume, em litros, corresponde a
Em uma fermentação alcoólica, conduzida a uma temperatura igual a 86 °F e pressão igual a 1 atmosfera, foram formados 24.846 m3 de gás carbônico. A produção de álcool a partir de glicose é representada pela reação abaixo
C6 H12O6 → 2 C2 H5 OH + 2CO2 (g)
Considerando-se que o gás carbônico tem comportamento ideal, o volume do etanol formado, em m3 , é
Dados:
R: constante dos gases ideais;
R = 0,082 atm.L/mol.K;
ρ : densidade do etanol;
ρ = 0,8 g/cm3 ;
utilize o valor da temperatura considerando número inteiro
Em um sistema gasoso, 2,0 mols de um gás considerado ideal ocupam um volume de 10 L a uma temperatura de 310 K. Se esse sistema gasoso sofresse compressão isotérmica, reduzindo seu volume a um quarto (1/4) do volume inicial, a pressão final do sistema gasoso seria igual, em atm, a:
Dado: R = 0,082 L.atm.mol-1 . K-1 = 8,31 J.K-1 .mol-1
 contém gás perfeito à temperatura de 27° C e à pressão de 996 Pa. O número de moléculas do gás no recipiente é
contém gás perfeito à temperatura de 27° C e à pressão de 996 Pa. O número de moléculas do gás no recipiente é
I. Gasodutos quando sob a forma gasosa.
II. Navios criogênicos quando sob a forma liquefeita.
III. Adicionados a outros materiais quando sob a forma de compostos derivados líquidos ou sólidos.
O gás deve ficar a uma temperatura de ?162 °C para ser acondicionado corretamente para o transporte, SOMENTE em