Questões de Concurso
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 334 questões
Um recipiente cilíndrico isolado, de 20 cm de raio, contém 2 kg de ar a 27ºC e pressão de 100 kPa. Uma resistência elétrica de volume desprezível, capaz de fornecer 15 W de potência, é colocada no interior do recipiente. Calcular o tempo de acionamento da resistência para que a pressão do ar atinja 200 kPa. Dados: Mar = 29kg/kmol, Patm = 100 kPa, Cvar = 0,7 kJ/kg.K, Pcrítica = 3800 kPa. Considere a hipótese de gás ideal.
Resposta:
Determine a pressão absoluta no reservatório onde está instalado o manômetro C ilustrado na figura abaixo. Dados: PA = 20 psi; PB = 10 psi; PC = 12 psi; Patm = 15 psi.
Resposta:

A figura acima apresenta as curvas do coeficiente de compressibilidade (Z) em função da pressão para dois gases, A e B, ambos a 273 K. Com relação a essa figura, julgue os itens a seguir.

A figura acima apresenta as curvas do coeficiente de compressibilidade (Z) em função da pressão para dois gases, A e B, ambos a 273 K. Com relação a essa figura, julgue os itens a seguir.
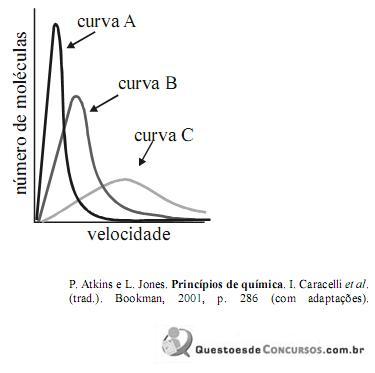
Com relação à figura acima, que apresenta as distribuições de velocidades de Maxwell para três diferentes gases a uma mesma temperatura, julgue o item seguinte.
A curva A corresponde ao gás com menor massa molar e a curva C, ao gás com maior massa molar.
I - Um balão cheio com 1 L de gás carbônico
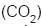 não flutua, mas murcha, porque o
não flutua, mas murcha, porque o 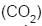 é mais denso do que o ar.
é mais denso do que o ar. II - Um balão cheio com hélio flutua porque este gás, apesar de ser mais denso do que o ar, possui menor volume molar, devido ao seu menor raio atômico.
III - Dois balões contendo 1 L de gás carbônico ou de hélio terão massas iguais destes gases, já que um mol de qualquer gás, nas condições ideais, ocupa 22,4 L.
(Dados: massa molar do
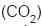 = 44 g/mol
= 44 g/mol massa molar do He = 4 g/mol
massa molar média do ar = 29 g/mol)
É(São) correta(s) APENAS a(s) afirmativa(s)
ma(Mn) = 55u.
A decomposição de 2,27 g de nitroglicerina nas CNTPs produzirá, ao todo, aproximadamente ________ litros de gases. Assinale a alternativa que completa corretamente a lacuna da frase acima.
MnO2 + 4HCl ? MnCl2 + 2H2O + Cl2
Admitindo-se uma pureza de 87% para o dióxido de manganês e um rendimento de reação de 90%, a massa de MnO2 , em g, necessária para produzir 20,16L de gás cloro, medidos a 0 ºC e 1atm, é
(Dados: Massas molares em g/mol: Mn = 55; O = 16; H = 1; Cl = 35,5; Volume molar a 0 ºC e 1atm = 22,4L)