Questões de Concurso
Comentadas sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 69 questões
São dadas as seguintes semi reações:
Considere que a reação da célula é espontânea e que o sistema entra em equilíbrio.
Nessas condições, é CORRETO afirmar que a constante de equilíbrio para a reação da célula é aproximadamente igual a
Um exemplo clássico de uma reação química em
equilíbrio é a reação entre o monóxido de
nitrogênio (NO) e o dióxido de nitrogênio (NO): 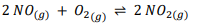
Nesta reação, o monóxido de nitrogênio (NO) reage com o oxigênio (O2) para formar dióxido de nitrogênio (NO2), e também ocorre a reação reversa, na qual o dióxido de nitrogênio (NO2) se decompõe para formar monóxido de nitrogênio (NO) e oxigênio (O2).
Assinale a alternativa que contém a equação para a constante de equilíbrio (KC) para esta reação.
Diante dessas informações, assinale a opção que mostra O VALOR DA CONSTANTE DE EQUILÍBRIO, Kp, para a reação de dimerização e a afirmação CORRETA que expressa a influência da pressão (FAVORECE OU DESFAVORECE) na dimerização:
Assinale a opção que indica o valor da constante de equilíbrio em função das pressões.
Um aumento de pressão no sistema onde ocorre a reação II favorece a decomposição do gás AB.
Representando-se por Kc e Kp as constantes de equilíbrio em termos de concentração e pressão, respectivamente, e considerando-se a constante universal dos gases ideais (R) igual a 0,082 atm∙L∙mol−1∙K−1, é correto afirmar que, para a reação I, com Kc = 30 a 573 K, tem-se Kc < Kp .
Considere-se que, processando-se a reação I em um recipiente fechado de 2 L na temperatura T1, o equilíbrio tenha sido atingido com 1 × 10−2 mol de A2, 2 × 10−2 mol de B2 e 4 × 10−2 mol de AB. Assim, caso a temperatura seja alterada para T2, na qual a constante de equilíbrio seja igual a 40, é correto afirmar que, a partir da condição de equilíbrio anterior, a reação favorecida será a inversa, no sentido da formação dos reagentes A2 e B2.
A relação entre as duas constantes de equilíbrio é K2= K1−2.
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
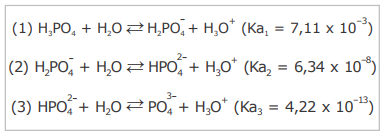
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion 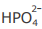 é maior que a concentração do ânion
é maior que a concentração do ânion 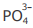 na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion 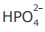 é maior que a concentração do ânion
é maior que a concentração do ânion 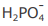 na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas
2HF(aq) + C2O42-(aq) ⇆ 2F-(aq) + H2C2O4(aq) Keq
Sabe-se ainda que
(I) HF(aq) ⇆ H+ (aq) + F– (aq) K1
(II) H2C2O4 (aq) ⇆ 2H+ (aq) + C2O4 2– (aq) K2
O valor da constante de equilíbrio Keq pode ser expresso em função das constantes K1 e K2 pela expressão
As velocidades de reação independem do mecanismo da reação, pois independem do número de espécies colidindo. A expressão da constante de equilíbrio depende apenas da estequiometria, que descreve a relação entre as concentrações de reagentes e produtos quando o sistema atinge o estado de equilíbrio químico.
Do ponto de vista cinético, o equilíbrio é um estado de máxima estabilidade para o qual um sistema químico fechado tende a partir de quaisquer outros estados; do ponto de vista termodinâmico, o equilíbrio é um estado dinâmico, em que cada espécie participante da reação se forma exatamente da mesma forma como é consumida.

Considerando essas informações, assinale a opção correta.
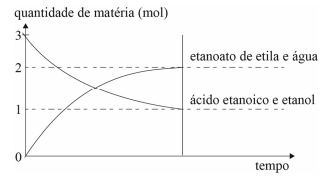
Nesse caso, a constante de equilíbrio da reação em apreço é igual a
A equação seguinte representa a reação de decomposição da água.
H2O (g) ⇌ H2 (g) + 1/2 O2 (g)
Considere que, em um recipiente de 5 L, tenham sido adicionados 225 g de água e, em seguida, esse sistema tenha sido aquecido a 2.000 °C, sob pressão de 1 atm. Assumindo-se que, nesse caso, 70% da água será decomposta e que a massa molar da água (MH20) é igual a 18,0 g/mol, é correto afirmar que a concentração de água remanescente, após a situação de equilíbrio, será de
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.