Considere que, em um recipiente de 2 L, esteja acontecendo a...
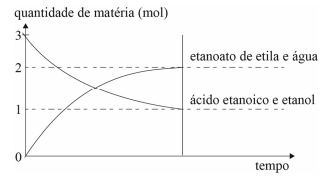
Nesse caso, a constante de equilíbrio da reação em apreço é igual a
- Gabarito Comentado (1)
- Aulas (3)
- Comentários (7)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
C = n/ V
Portanto nao seria [etanoato] = 2/2 = 1 e [acido] = 1/2 = 0,5. Logo kw = [etanoato] / [acido] = 1/0.5 = 2
Mas a resposta certa esta como 4...
Alguém pode me explicar, por favor? Meu resultado deu 2.
Kc= [produto] / [reagente]
Kc = [etanoato] / [ácido etanoico].[etanol]
Kc = [2/2] / [1/2].[1/2]
Kc = [1] / [0,5].[0,5]
Kc = [1] / [0,25]
Kc = 4
Letra C.
eu fiz assim :
usa a tabela
no inicio: produto: 3mol/2L e reagente 0
reagiu : produto : 1mol/2L e reagente: 2 mol/L(equilíbrio)
final : produto: 0.5mol/L e reagente : 2 mol/L
Kc= 2mol/L / 0.5mol/L = 4
tem 1 mol/L de produto e dois reagentes contendo 1/2mol/L
kc= prod/reag. reag.
kc= 1/0.5 x 0.5
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo