Questões de Concurso
Sobre sistemas homogêneos: equilíbrio iônico: conceitos, diluição de ostwald, efeito do íon comum. em química
Foram encontradas 46 questões
I. A temperatura crítica de pite é definida como a temperatura em que a corrente excede 100 microA/cm2 por 60s.
II. A temperatura crítica de pite é obtida através de técnica potenciodinâmica.
III. Em geral, o potencial crítico de pite diminui com o aumento da temperatura.
Dentre essas afirmativas, está(ão) correta(s)
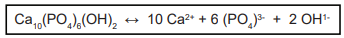
A solução aquosa capaz de evitar a desmineralização dos dentes é:
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
Segundo Arrhenius, o ácido bórico forma uma solução eletrolítica porque é capaz de se ionizar na presença de água, formando íons livres em solução.
Considerando os dados apresentados, assinale a alternativa que contém a afirmativa correta.
O H2S (g) se dissocia completamente em água.
Observe a tabela a seguir que contém os valores de pKa para cinco ácidos inorgânicos distintos.
ÁCIDO pKa carbônico 6,37 hipocloroso 7,53 hipobromoso 8,69 bórico 9,14 cianídrico 9,31
O ácido mais forte é o
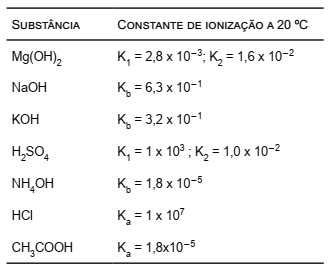
A tabela a seguir contém os valores das constantes de equilíbrio de alguns ácidos e bases.
Uma das reações de identificação dos íons magnésio consiste em precipitá-lo com base forte, formando o hidróxido de magnésio, branco, segundo a equação:
Mg2+ (aq) + 2OH–(aq)  Mg(OH)2
(s)
Mg(OH)2
(s)
O precipitado formado pode ser dissolvido quando ao
meio aquoso é adicionado o sal
Analise os óxidos apresentados em cada item e indique aquele que apresenta o maior caráter iônico dentre eles:
O Ca(OH)2 é ____________, ou seja, em solução aquosa está ____________.
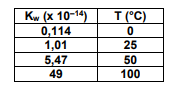
Como acontece com todas as ionizações, a água também se ioniza em um processo reversível até atingir um estado de equilíbrio, denominado equilíbrio iônico da água. A respeito dos conceitos do produto iônico da água e de pH e pOH, julgue o item a seguir. Dado: Kw = 1,0x10-14.
A expressão matemática do produto iônico
da água é: Kw = [H+] / [OH-
].


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização
ácida do H2O2 é superior a 2,0%.
Um volume de 500 mL de uma solução aquosa, contendo 0,0040 mol L-1 de Ba2+ foi misturada com 500 mL de uma solução 0,0060 mol L-1 de ácido sulfúrico, promovendo a reação conforme ilustrado na Equação I a seguir:
Ba2+ (aq) + H2SO4 (aq) → BaSO4 (s) + 2 H+ (aq) (Equação I)
O BaSO4 produzido se dissocia, estabelecendo um equilíbrio de solubilidade como indicado na Equação II a seguir:
BaSO4(aq) ⇋ Ba2+ (aq) + SO42- (aq) ; Kps = 1 x 10-9 (Equação II)
A solução resultante (de volume igual a 1000 mL) se encontra a 25°C. Conforme as condições indicadas, e ignorando a
influência da força iônica no equilíbrio de solubilidade, mas considerando o excesso de SO42- em solução, a concentração
aproximada de Ba2+ residual na solução, em mol L-1
, é
O equilíbrio de dissociação da água é mostrado na equação de equilíbrio a seguir:
H2O ⇋ H+ + OH-
A 25°C, a constante de equilíbrio (Kw) é dada por:
Kw = [H+] [OH- ] = 1,0 x 10-14
Ao se misturarem 50 mL de uma solução aquosa do ácido
forte HCℓ (0,01 mol L-1
) com 20 mL de solução aquosa da
base forte KOH (0,02 mol L-1
) e água suficiente para se
levar o volume final a 100 mL, o pH da solução resultante,
a 25°C, será
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução aquosa de H2S, a ordem
decrescente de concentração das espécies presentes
é [H2O] > [H3O+
] > [H2S] > [S2- ] > [HS- ].