Questões de Concurso
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 491 questões
Leia o texto para responder às questões de 32 a 34. Ao ser contratado, o técnico observou que foram acumulados, no laboratório, vários frascos com resíduos químicos que devem ser tratados e/ou encaminhados para descarte correto. Consultando uma central de resíduos já estabelecida, ele encontrou algumas informações que poderiam auxiliar nesse processo. Por exemplo, soluções aquosas de sais inorgânicos de metais alcalinos e alcalinos terrosos: NaCl, KCl, CaCl2, MgCl2, Na2SO4, MgSO4 e tampões PO43-, não contaminados com outros produtos, devem ser diluídos e descartados diretamente na rede de esgoto. Soluções de ácidos ou bases inorgânicas: H2SO4, HCl, H3PO4, HNO3, KOH, NaOH, Na2CO3, K2CO3, NaHCO3, KHCO3. devem ser diluídas e neutralizadas, podendo, então, serem desprezadas na rede de esgoto, desde que não contaminadas com outros produtos.
A primeira etapa foi a identificação dos frascos buscando segregar os resíduos que são passíveis de destruição /neutralização no próprio laboratório, para posterior descarte na pia. Três frascos foram separados, pois se enquadravam nessa situação. Eles estavam classificados como descrito abaixo:
Frasco | Quantidade | Composição sugerida |
1 | 9,6L | Resíduo da reação de H2SO412 mol L-1 com Magnésio metálico e água de lavagem. |
2 | 12,4L | Solução de Bicarbonato de sódio (NaHCO3) e Ácido clorídrico (HCl). |
3 | 11,2L | Resíduo de KOH 6 mol L-1 com água de lavagem. |
Prezando pela segurança, este técnico buscou confirmar o máximo de informações apresentadas nesses rótulos, antes de proceder a qualquer tratamento. Assim, ele realizou alguns ensaios com amostras dos resíduos de forma a verificar aspecto físico, coloração, presença de precipitados, pH e ainda testes qualitativos para íons.
Disponível em: <https://www.sgas.ufscar.br/degr/residuos/residuos-quimicos/tratamento-no-laboratorio> (Com adaptações). Acesso em: 17. Abr. 2024.
Uma das propriedades relevantes dessas soluções que deve ser confirmada é o pH, que indicaria se a solução é ácida, neutra ou básica, como se espera para os frascos 1, 2 e 3, respectivamente. Essa medida de acidez e basicidade pode ser feita, qualitativa ou quantitativamente, no laboratório de Química usando diferentes equipamentos, vidrarias e/ou reagentes.
Das alternativas abaixo, qual apresenta as três possibilidades adequadas para estimar o pH das soluções?
Leia o texto a seguir para responder às questões de 21 a 23.
Alfenas está situada no Sul de Minas, às margens do Lago de Furnas, um dos maiores lagos artificiais do Brasil. Embora o objetivo inicial da construção desse lago tenha sido a geração de energia a partir da construção de uma usina hidrelétrica, ao longo destes 60 anos as atividades turísticas e recreativas se intensificaram nessa região e não é mais possível imaginá-la sem visitantes. Contudo, recentemente uma reportagem trouxe uma preocupação para a região. Um estudo da UFMG indicou que atividades humanas como a agricultura, pecuária e lançamento do esgoto in natura podem ter afetado a qualidade da água do Lago de Furnas. Em suas análises, a pesquisadora considerou dados oficiais de monitoramento das águas em Minas Gerais relativos às bacias que alimentam o Lago de Furnas, considerando os parâmetros de turbidez, pH, densidade de cianobactérias e os níveis de E. coli.
Quando nos referimos a contaminantes inorgânicos, como cromo, mercúrio, chumbo ou cadmio, a presença destes em fontes hídricas ou até mesmo nos peixes que ocupam essas fontes é comum, dadas as atividades cotidianas ou industriais que ocorrem nos municípios ao redor. E outra atividade frequente na região de Furnas refere-se à pesca esportiva ou como fonte de renda, com criação especialmente de tilápias em tanques. Embora não tenha sido apontado no estudo, o monitoramento constante dos níveis de contaminantes, sobretudo os inorgânicos, nas águas do lago, é crucial para garantir a qualidade do peixe que chega à mesa dos mineiros e seus visitantes.
Disponível em: <https://ufmg.br/comunicacao/noticias/presenca-de-contaminantes-fecais-no-lago-de-furnas-pode-estar-acima-do-permitido> (Com adaptações). Acesso em: 17 abr. 2024.
No estudo realizado na UFMG, é mencionado que uma das análises feitas foi do pH das amostras de água do lago. O pH é uma escala bastante útil em Química já que a concentração dos íons hidrônio [H3O+] pode variar em várias ordens de grandezas. Assim, evitando uma faixa extensa de valores, o pH é expresso em termos do logaritmo negativo (na base 10) da concentração dos íons hidrônio, em mol por litro, ou seja, pH = - log [H3O+]. Contudo, essa definição é uma simplificação que se aplica às soluções suficientemente diluídas, já que o pH dessas soluções é medido orginalmente com base na ___________ dos íons H3O+.
Assinale a alternativa que completa corretamente a lacuna do texto:
O detergente neutro é um produto químico de limpeza responsável pela higienização mais básica das superfícies e utensílios. O fato de ser neutro significa que o valor do seu pH é de:
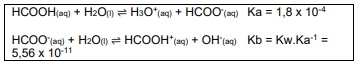
Calcule a concentração de íons hidrônio de uma solução tampão obtida pela mistura das soluções ácido fórmico 0,25 mol L-1 e formiato de sódio 0,9 mol L-1.
Em relação a esse fato, os valores de pH e pOH representam um modo de exprimir a [H+] de uma solução aquosa e, indiretamente, expressar também sua [OH-]. Assim, sabendo-se que uma pessoa diluiu 40.0 mL de seu suco gástrico (solução contendo ácido clorídrico), de pH = 1.0, ao tomar dois copos de água, levando a solução resultante a apresentar um volume final de 400.0 mL, caracterizando uma diluição, o pH da solução resultante logo após a ingestão da água será:
HInd + H2O → H3O+ + Ind– Ki = [HInd] / [H3O+] . [Ind–]
Sabe-se que o olho humano consegue identificar a mudança de cor quando:
[HInd] = 10[Ind–] cor A [Ind–] = 10[Hind] cor B
Assinale a alternativa que apresenta corretamente o intervalo de pH em que ocorre a mudança de cor de um indicador, cuja Ki = 10-7.

Nessas condições, o ácido mais fraco é o:
I. A temperatura crítica de pite é definida como a temperatura em que a corrente excede 100 microA/cm2 por 60s.
II. A temperatura crítica de pite é obtida através de técnica potenciodinâmica.
III. Em geral, o potencial crítico de pite diminui com o aumento da temperatura.
Dentre essas afirmativas, está(ão) correta(s)
O pH dessa solução é
Dado log 3 = 0,5
Em uma titulação de neutralização é possível a representação gráfica do ponto final da titulação (pH x
titulante). Em uma titulação de NH4OH com HCl, o gráfico que representa a curva de titulação dessa
reação é
“Em uma solução ácida a concentração de íons hidrogênio (hidrônio) é maior do que a de íons hidróxido”.
Considerando uma solução de HCl de concentração 4,6.10-3 mol.L-1 (log 4,6 = 0,66), a alternativa que indica o pH e o pOH corretamente é:
(RUSSEL, Química Geral, vol. 2, Editora Pearson, 1994)
A concentração do íon hidrogênio [H+] no sangue é mantida dentro de limites estreitos no estado saudável. Em relação às desordens ácido-base, assinale a alternativa correta.
As antocianinas e seus derivados são pigmentos naturais polares da classe de compostos orgânicos chamados flavonoides e estão presentes nas uvas, sendo responsáveis pela cor do vinho tinto. Tais pigmentos são substâncias fenólicas que podem ter diversas cores, como vermelha, roxa, azul, e podem ser encontrados também em pétalas de flores, framboesa, figo, cereja, amora, beterraba, romã, maçã, cebola roxa, repolho roxo entre outros. O extrato aquoso obtido a partir do repolho roxo tem cor roxa e pH 7, a
 , contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH:
, contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH: 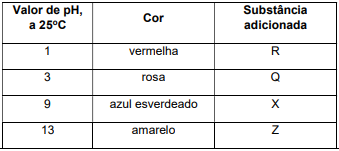
Pode-se verificar então que o extrato aquoso de repolho roxo funciona como um indicador de pH. A solução aquosa da substância R, adicionada a este extrato, pode ser de