Questões de Concurso
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 138 questões
A fenolftaleína é um indicador ácido-base cuja faixa de viragem está descrita abaixo.
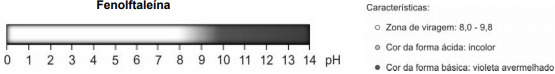
Espera-se observar a cor avermelhada ao colocar a fenolftaleína na solução resultante da mistura de água com
I. cloreto de amônio.
II. sódio metálico.
III. carbonato de sódio.
IV. sal de cozinha.
Está correto o que se afirma em
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
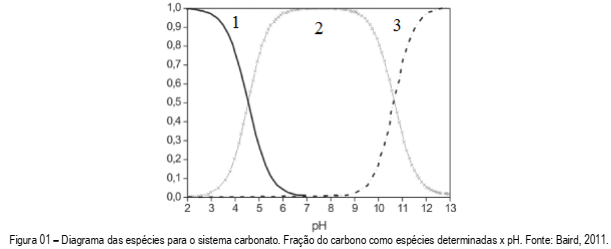
A química ácido-base de muitos sistemas de águas naturais, que inclui rios e lagos, é dominada pela interação do íon carbonato com o ácido carbônico, sendo o equilíbrio entre as espécies dependente do pH do meio. No gráfico abaixo, as espécies predominantes no sistema carbonato estão representadas por números 1, 2 e 3. Observando o gráfico, assinale a alternativa que correlaciona a numeração com a espécie, respectivamente.
O denominado potencial hidrogeniônico (pH) ou índice de Sorensen é usado para realizar a medida da concentração de íons H+ . O valor do pH para uma solução de HCl 0,5M, cujo grau de ionização é de 80%, é de:
Dado: log 2 = 0,3.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pela definição de Brønsted‐Lowry, um ácido é uma
espécie que tem a tendência de perder ou doar um
próton e uma base é uma espécie que apresenta a
tendência de receber ou adicionar um próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Como a água é um eletrólito forte, sua ionização pode ser representada por: 2 H2O → H3O+ + OH− , sendo a constante de autoprotólise da água escrita por:
KW = [H3O+
]−1 ∙ [OH−]
−1.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização
ácida do H2O2 é superior a 2,0%.
Com base nessa situação hipotética, assinale a alternativa que apresenta o valor do pH da solução formada após a realização da mistura.
Assinale a opção que indica o par que pode ser utilizado para o preparo de um tampão básico.
Responsável pelo abastecimento de 12 milhões de pessoas na Região Metropolitana do Rio (80% da população), o Rio Paraíba do Sul está na iminência de uma catástrofe em Volta Redonda, no Sul Fluminense. O alerta consta na denúncia 1518/18, aceita pelo Ministério Público Federal, que abriu inquérito para apurar responsabilidades (...) A ação adverte para o risco de deslizamento de uma pilha gigante, sem contenção, de escória. Adaptado de https://odia.ig.com.br/rio-de-janeiro/2018 Acesso em 18/06/2018
A pilha de escória contém areia, cal virgem, enxofre e metais tóxicos como manganês, zinco, cádmio, crômio, níquel e chumbo e corre o risco de escorregar com a ação das chuvas e contaminar o rio Paraíba do Sul e os lençóis freáticos.
Assinale a opção que indica o problema ambiental que esta contaminação pode causar ao ambiente aquático.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Todo par ácido fraco/base conjugada pode agir mais
eficientemente como tampão em valores de pH próximos à
neutralidade (pH = 7).
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Por ser um ácido fraco, o ácido lático dissocia-se parcialmente
em água, formando lactato e H+
, até atingir um equilíbrio
químico.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Eletrólitos são substâncias que se ionizam em água, formando
cátions e ânions.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
A natureza química da água faz desta um excelente solvente
para moléculas apolares.