Questões de Concurso
Comentadas sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 132 questões
Atenção: Para responder à questão, considere a curva de titulação abaixo.

Observe a curva de titulação do ácido fosfórico H3PO4 . As setas indicam a faixa de pH onde predominam seus íons correspondentes.
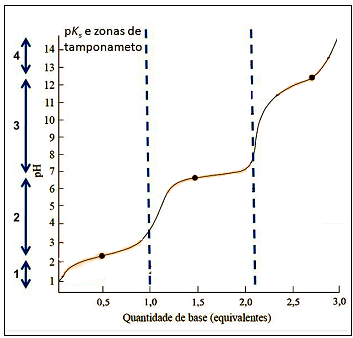
Em qual faixa de pH predomina o íon HPO42-?
Um resíduo aquoso, de volume igual a 30,0 L, contém dissolvidos 1,0 × 10-2 mol L-1 de Pb2+ e 2,0 × 10-2 mol L-1 de Hg22+. Esses íons foram precipitados com a adição de uma solução aquosa de ácido sulfúrico 1,0 mol L-1 , de acordo com as equações a seguir, em volume suficiente para garantir excesso de sulfato.
Pb2+ (aq) + SO4 2- (aq) → PbSO4 (s)
Hg2 2+ (aq) + SO4 2- (aq) → Hg2 SO4 (s)
A massa de precipitado, em gramas, que seria obtida, considerando a reação quantitativa, é mais próxima de
Dados
M (PbSO4 ) = 303 g mol-1
M (Hg2 SO4 ) = 497 g mol-1
O gráfico a seguir apresenta a solubilidade de uma substância em diversas temperaturas.
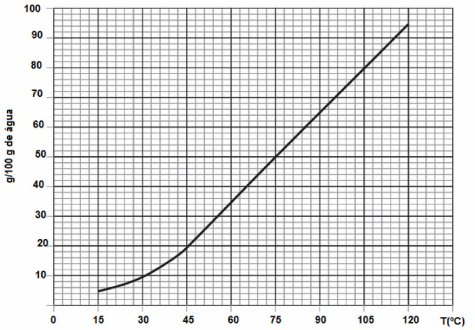
Em um bequer, 150 gramas dessa substância foram solubilizadas em 250 gramas de água, até a temperatura de 105°C. Em seguida, a solução foi resfriada em 30°C. A massa da substância,
em g, que se deposita no fundo do béquer é igual a
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH- ] e pKb = -log Kb, julgue o seguinte item.
Uma solução-tampão constituída por NH4Cℓ 0,040 mol/L e NH3 (aq) 0,030 mol/L apresenta pOH superior ao pKb da NH3.
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH- ] e pKb = -log Kb, julgue o seguinte item.
A solubilidade de um sulfeto metálico é tanto menor quanto
maior for a acidez do meio.
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita,
tiverem sido gastos 16,0 mL da solução que contenha o
excesso de NaOH, então infere-se que a concentração da
solução de H2S é igual a 9,00 × 10-2
mol/L.
Uma amostra contém Ba2+ e Ca2+ nas concentrações de 1 x 10-2 mol L-1 para cada íon. Esses íons devem ser precipitados na forma de sulfatos pouco solúveis, como apresentado nas equações abaixo.
BaSO4(s) ⇌ Ba2+(aq) + SO42-(aq) ; Kps1 = 1 x 10-10
CaSO4(s) ⇌ Ca2+(aq) + SO42-(aq) ; Kps2 = 1 x10-5
Quando a concentração de SO42- atingir um valor para permitir o início da precipitação do CaSO4, a concentração de Ba2+ na solução estará na ordem de grandeza, em mol L-1, de
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
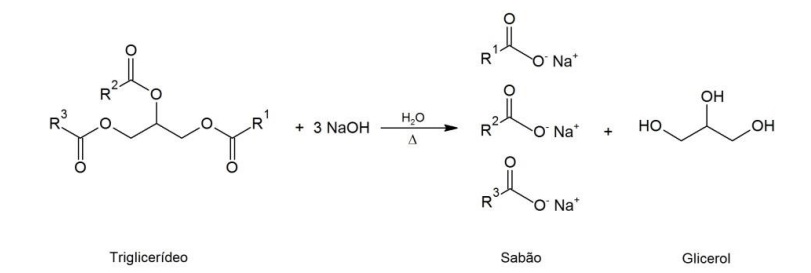
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
Foi realizada uma aula experimental visando a síntese de uma amida aromática, a acetanilida (ou N-fenil-acetamida), de acordo com o procedimento experimental resumidamente descrito a seguir:
Em um béquer limpo e seco, misturar o ácido acético glacial e o acetato de sódio anidro. Adicionar a anilina e, em seguida, o anidrido acético. Após 10 minutos de reação, verter o meio reacional sobre água destilada gelada, sob agitação. A acetanilida precipita. Filtrar em funil de Büchner e lavar o produto bruto com água destilada gelada até pH neutro. Purificar a acetanilida por recristalização usando água quente e carvão ativado.
Sobre esse procedimento, considere as seguintes afirmativas:
1. A reação envolvida na síntese da acetanilida é uma reação de acilação.
2. Foi utilizada água gelada na etapa de precipitação da acetanilida bruta para reduzir as perdas de produto por solubilidade em água.
3. A purificação do produto bruto foi realizada em água quente porque a acetanilida é mais solúvel em água quente que em água fria.
4. O carvão ativado foi utilizado para acelerar a precipitação da acetanilida.
Assinale a alternativa correta.
A = 0,1 g B = 0,5 g C = 2,5 g D = 7,5 g
Com base na solubilidade do sal, a 25°C, que é igual a 7,06 g /100 mL de água, em qual(is) tubo(s) o permanganato de potássio estará totalmente dissolvido, após agitação?
Análise quantitativa que se realiza para determinar a concentração de uma solução. Permite dosar uma solução e determinar a sua quantidade por intermédio de outra solução de concentração conhecida. Sendo que a solução padrão é a que se conhece a concentração, e a solução problema é aquela da qual procura-se o valor.
De uma forma geral as águas subterrâneas e superficiais que podem ser tratadas para tornarem-se potáveis, apresentam uma infinidade de contaminantes, ou substâncias indesejáveis ao meio. Por esta razão métodos de tratamento robustos e versáteis ganham espaço a fim de garantir a qualidade da água servida para a população. O esquema a seguir apresenta uma das formas de tratamento de águas subterrâneas.
Dados: Ks [CaSO4] = 1,9.10-4; Ks [Ca3(PO4)2] = 1,1.10-28
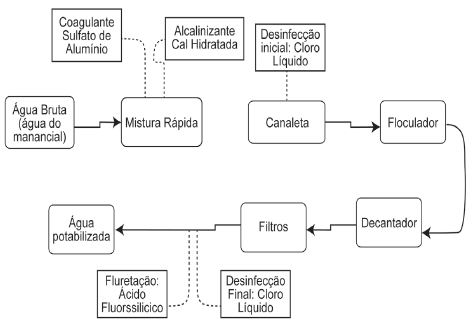
Analise as propostas a seguir:
I. A presença do íon sulfato como coagulante é o procedimento mais comum de tratamento, poderia ser substituída pelo íon fosfato no sistema com a finalidade de reduzir a dureza da água.
II. Após a mistura rápida do coagulante ao sistema devese desacelerar a mistura a fim de que o floco aumente de tamanho, facilitando sua retirada.
III. A faixa de ação do pH ao longo sistema de tratamento varia, com isso garante-se a estabilidade das espécies químicas formadoras do floco e as desinfectantes, que necessitam valores diferentes ao longo do fluxo.
É correto apenas o que se afirma em:
A figura a seguir apresenta duas curvas quase que sobrepostas, correspondentes ao mesmo procedimento: a curva de titulação entre um fármaco ácido e NaOH e a curva obtida quando se tira a 1ª derivada da curva de titulação. Analise as afirmações e escreva V para verdadeiro ou F para falso:
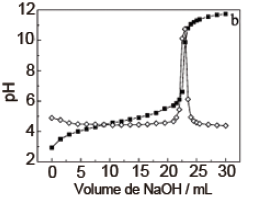
( ) A titulação envolve ácido fraco e base forte, se não fosse potenciométrica a utilização de fenolftaleína como indicador, teria preferência a utilização de alaranjado de metila.
( ) O p.e. (ponto de equivalência) será em pH igual 7.
( ) o pKa do titulado é próximo a 5.
( ) A derivada da curva tem por finalidade indicar o volume gasto até o p.e. para a neutralização.
( ) O sitema atua como um tampão na faixa 4<pH<5,5.
Assinale a alternativa correta quanto ao verdadeiro ou falso: