Questões de Concurso
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 284 questões
A concentração é uma característica importante para análise e interpretações de propriedades para as soluções e um dado necessário para seu uso no laboratório, na indústria e no cotidiano.
Abaixo, estão desenhados recipientes com os respectivos volumes de solução e massas de hidróxido de sódio (NaOH = 40g/mol).
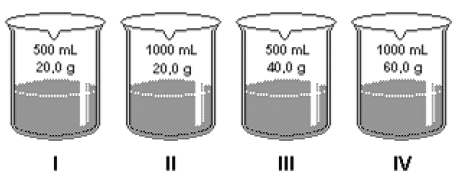
I. A solução contida no frasco I apresenta concentração de 1,0 mol/L;
II. As 4 soluções apresentarão pH acima de 7;
II. A solução mais concentrada está presente no frasco III.
São corretas as afirmações:
sal ΔHsol (kJ/mol) solubilidade em água a 18 ºC (g/100 mL)
LiF +32 0,3
KF +2 92,3
RbF 3 130,6
Considerando os dados na tabela precedente, que lista alguns sais
e seus respectivos valores de entalpia de dissolução (ΔHsol) e
solubilidade, assinale a opção correta a respeito de soluções e
propriedades de soluções.
Para preparar 500 mL de uma solução de ácido clorídrico, HCl, 6,0 mol/L, um funcionário de um laboratório químico empregou uma solução de ácido clorídrico de concentração 12 mol/L.
O volume do ácido clorídrico 12 mol/L empregado para a preparação da solução 6,0 mol/L foi
Um funcionário de laboratório de análises precisa preparar 1 L de uma solução de hidróxido de sódio, NaOH, massa molar 40 g/mol, com concentração 0,5 mol/L.
Assinale a alternativa que apresenta a massa de hidróxido de sódio que deve ser empregada para o reparo dessa solução.
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
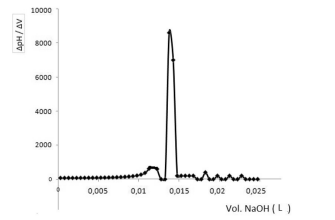
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
Dado: MM CuCl = 99 g.mol-1
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
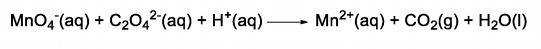
A semirreação de redução está corretamente representada em:
Um dos ligantes mais amplamente utilizados nas titulações de complexação é o EDTA, cuja fórmula estrutural é mostrada abaixo:
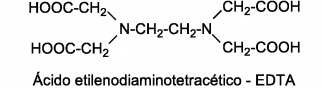
Sobre esse importante reagente, é incorreto afirmar:
Para determinar a pureza de uma amostra de 500,0 mg de Na2B4O7(s), um técnico realizou uma titulação com solução de HCl 0,020 M. A reação é:
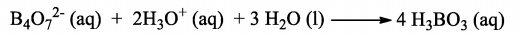
Sabendo que o volume utilizado da solução ácida foi 200,0 mL, é correto afirmar que a pureza da amostra em termos percentuais é:
Massas molares (g/mol): H = 1; B = 11; O = 16; Na = 23; Cl = 35,5.
Deseja-se preparar 800 mL de solução aquosa de hidróxido de sódio com pH igual a 12 e a 25 °C.
Assumindo-se completa dissociação do hidróxido de sódio em solução, a massa de base necessária para o preparo da solução, em g, corresponde a
Em uma prática de laboratório, 1 L de solução aquosa foi obtido ao se misturar 600 mL de solução 0,010 mol/L de cloreto férrico e 400 mL de solução 0,020 mol/L de cloreto de cálcio.
Admitindo-se completa dissociação dos sais, a concentração de íons cloreto na mistura formada, em mol/L, é igual a
Massas atômicas: H = 1; N = 14; O = 16.
