Questões de Concurso
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 284 questões
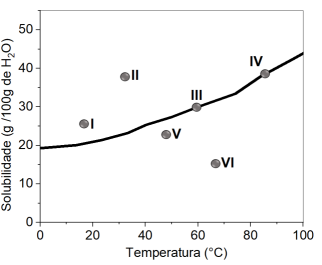
A partir da análise do perfil de solubilidade do sal, é correto afirmar que ocorre a formação de precipitado apenas nos seguintes sistemas:
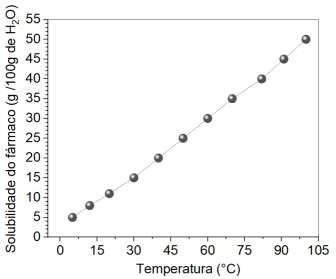
Se o químico optar por trabalhar com 40 g de água a 60°C, a quantidade máxima da substância que será dissolvida é:
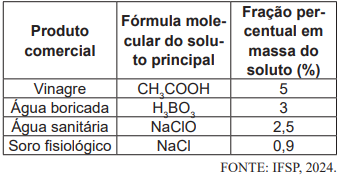
Uma pessoa possui, em sua casa, exatamente 100 mL de cada um dos produtos comerciais da tabela acima. Considerando os valores da fração percentual em massa do soluto na tabela acima, que a densidade de todas as soluções químicas é de 1,0 g mL-1 e que as soluções são formadas exclusivamente pelo soluto principal presente em água, escolha a alternativa que representa a menor concentração molar (mol L-1) do soluto em água.
Dados: H = 1,0 g mol-1; B = 10,8 g mol-1; C = 12,0 g mol-1; O = 16,0 g mol-1; Na = 23,0 g mol-1; Cl = 35,5 g mol-1

Nessa localidade há um rio em que ocorre despejo de efluentes industriais de uma empresa do ramo metalúrgico. Em um procedimento de fiscalização, uma amostra desse efluente foi coletada para análise e identificou-se a presença tanto de íons Cr2+ como de íons Hg2+ em concentrações de 1,0 x 10-3 g/L e 1,5 x 10-3 g/L, respectivamente. Considerando a densidade da amostra igual a 1g/cm3 , é correto afirmar que:
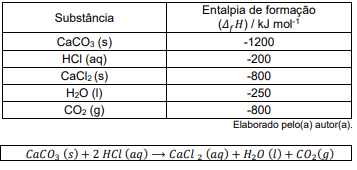
Dadas as entalpias de formação das substâncias listadas na tabela e considerando a equação acima, qual o valor da entalpia de reação para a reação, em kJ mol-1?
Use: Massas Molares: O = 16,0 g mol-1; C = 12 g mol-1; H = 1 g mol-1; N = 14 g mol-1; Cl = 35,5 g mol-1
Massas Molares: O = 16,0 g mol-1; C = 12 g mol-1; H = 1 g mol-
Em seguida, retirou-se da solução intermediária uma alíquota de 200mL que foi diluída até perfazer a solução na concentração desejada.
A quantidade de água que foi adicionada, em mL, à última alíquota foi de
Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue o item subsequente.
Titulação potenciométrica é um método analítico utilizado
para determinar a concentração de uma substância em uma
solução com base na medição do potencial elétrico gerado
durante uma reação química.
O efeito da temperatura na solubilidade dos solutos é, para maioria dos casos de soluções formadas por substâncias sólidas em outras líquidas, uma relação diretamente proporcional, ou seja, quanto maior a temperatura maior a solubilidade. A figura abaixo ilustra esse comportamento.
Disponível em: https://s2.static.brasilescola.uol.com.br/img/2018/12/grafico-com-curvas-de-solubilidade.jpg. Acesso em: 15 fev. 2021.
Assinale a alternativa que apresenta a explicação para o fato descrito.
Com base no gráfico a seguir, que representa as curvas de solubilidade de cinco substâncias em água, analise as afirmativas:
Dado: densidade da água a 10 °C e a 50 °C = 1,0 kg L-1 .
I – A dissolução do nitrato de sódio em água é um processo endotérmico.
II – Na temperatura de 20 °C, é possível solubilizar iguais quantidades de matéria, em mol, de nitrato de potássio e de cloreto de potássio em água.
III – Para preparar uma solução saturada de cloreto de potássio em 500,0 mL de água a 70 °C, seria necessário dissolver aproximadamente 250,0 g do sal no solvente.
IV – A dissolução de uma amostra de sulfato de cério III em uma quantidade adequada de água, de forma a se obter uma solução insaturada, forma uma mistura homogênea com maior temperatura de ebulição em relação à água pura.
V – Dissolvendo-se completamente 1 mol de cada um dos cinco sais mencionados no gráfico em cinco amostras de água de mesmo volume, de forma que cada amostra de água recebesse apenas um dos sais, obter-se-iam cinco soluções com igual pressão de vapor a uma mesma temperatura.
VI – Uma solução saturada de nitrato de potássio a 50 °C deve apresentar concentração de aproximadamente 8,0 mol L-1.
Das afirmativas feitas, estão corretas apenas
Fonte: USBERCO, João; KAUFMANN, Philippe Spitaleri. Conecte Live Química. 1ª Edição. São Paulo: Editora Saraiva, 2020, v. único, parte II, p. 191.
Um objeto, em um recipiente contendo 10 mL de etanol e 30 mL de água, encontra-se em equilíbrio, conforme representado na figura a seguir:
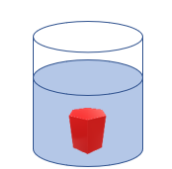
Considere que não houve contração de volume, que a água e o etanol solubilizam-se em qualquer
proporção e que as densidades da água e do etanol são, respectivamente, 1,0 g.mL-1 e 0,8 g.mL-1
.
Com essas informações, é correto afirmar que o valor aproximado da densidade do objeto será de
I. A mistura de 5 g de soluto em 250 mL de água destilada resultará em uma solução 2% m/V.
II. O hidróxido de magnésio, vendido em farmácias para azia, é considerado como uma solução verdadeira e homogênea.
III. O ácido clorídrico é considerado um padrão primário, implicando que sua solução não requer análises para a determinação da concentração real.
Está correto o que se afirma apenas em
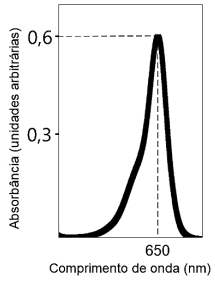
Considerando o espectro coletado e um coeficiente de absortividade molar de 40.000 L/(mol.cm) para o analito, a concentração da substância em µmol/L (micromol/L) determinada pela Lei de Lambert-Beer será de, aproximadamente:
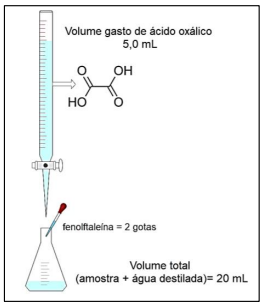
Considerando as informações fornecidas e a imagem, a concentração real da solução preparada de NaOH será de:

De acordo com essas informações, é correto afirmar que as concentrações molares dos ácidos clorídrico e nítrico são respectivamente, de