Questões de Concurso
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.034 questões
Dados os seguintes valores de massas molares (g/mol): CaCO3: 100; HCl: 36,5; NaOH: 40.
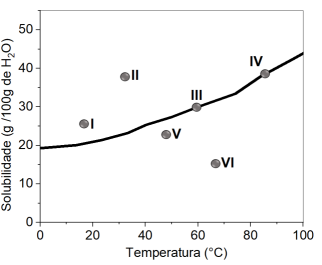
A partir da análise do perfil de solubilidade do sal, é correto afirmar que ocorre a formação de precipitado apenas nos seguintes sistemas:
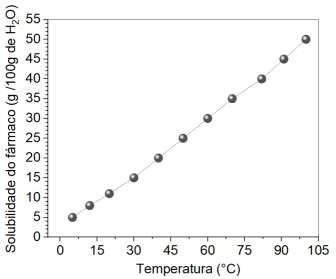
Se o químico optar por trabalhar com 40 g de água a 60°C, a quantidade máxima da substância que será dissolvida é:
AB(s) ⇌ A+ (aq) + B− (aq)
É correto afirmar que a solução saturada do sal, a 25°C, apresentará a seguinte concentração:
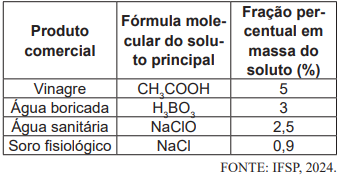
Uma pessoa possui, em sua casa, exatamente 100 mL de cada um dos produtos comerciais da tabela acima. Considerando os valores da fração percentual em massa do soluto na tabela acima, que a densidade de todas as soluções químicas é de 1,0 g mL-1 e que as soluções são formadas exclusivamente pelo soluto principal presente em água, escolha a alternativa que representa a menor concentração molar (mol L-1) do soluto em água.
Dados: H = 1,0 g mol-1; B = 10,8 g mol-1; C = 12,0 g mol-1; O = 16,0 g mol-1; Na = 23,0 g mol-1; Cl = 35,5 g mol-1
Quanto às soluções, julgue o item seguinte.
Ocorre uma reação de precipitação quando iodeto de chumbo (PbI2) e nitrato de potássio (KNO3) reagem formando nitrato de chumbo (Pb(NO3)2) e iodeto de potássio (KI) sólidos, através da equação apresentada a seguir.
PbI2 (aq) + 2 KNO3 (aq) → Pb(NO3)2 (s) + 2 KI (s)
Quanto às soluções, julgue o item seguinte.
Um composto molecular dissolve‑se em água
formando, invariavelmente, moléculas carregadas
eletricamente (íons) dispersas pela solução, formando
um eletrólito.
Quanto às soluções, julgue o item seguinte.
Quando em solução aquosa, os íons positivos
provenientes de um sólido iônico (cátions) são atraídos
pelo lado negativo da molécula da água, enquanto os
íons negativos (ânions) são atraídos pelo lado positivo.
Quanto às soluções, julgue o item seguinte.
Quando o cloreto de sódio (NaCl) se dissolve em água,
cada íon separa‑se da estrutura cristalina e dispersa‑se
pela solução, ou seja, o sólido iônico dissocia‑se em
seus íons constituintes à medida que se dissolve.
Massas molares em g/mol: C = 12; O = 16; Ca = 40

Nessa localidade há um rio em que ocorre despejo de efluentes industriais de uma empresa do ramo metalúrgico. Em um procedimento de fiscalização, uma amostra desse efluente foi coletada para análise e identificou-se a presença tanto de íons Cr2+ como de íons Hg2+ em concentrações de 1,0 x 10-3 g/L e 1,5 x 10-3 g/L, respectivamente. Considerando a densidade da amostra igual a 1g/cm3 , é correto afirmar que:
É frequente o uso de açúcar (sacarose, C12H22O11) como ingrediente em sucos, refrigerantes, chás e muitos outros produtos, a fim de adoçar e, consequentemente, tornar seu sabor mais atrativo e agradável. Porém, é importante saber que o seu consumo em excesso pode estar associado a diversos problemas de saúde, como a obesidade, diabetes e doenças cardiovasculares. Suponha que o rótulo de um chá gelado (250 mL), de uma determinada marca, mostra em seus ingredientes que há 2 g de sacarose. O cliente, não muito satisfeito com o sabor doce, resolveu adicionar 20 mL de água em seu copo que já continha 80 mL do chá comercial. Diante do exposto, calcule a concentração em mol/L de sacarose no chá gelado comercial e a concentração em g/L de sacarose no seu copo após adição de água.
Dados: C: 12 u, H: 1 u, O: 16 u.
Assinale a afirmativa CORRETA que apresenta a concentração em mol/L de sacarose no chá gelado comercial e a concentração em g/L de sacarose no copo do cliente, respectivamente.
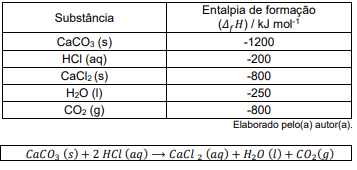
Dadas as entalpias de formação das substâncias listadas na tabela e considerando a equação acima, qual o valor da entalpia de reação para a reação, em kJ mol-1?