Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 1.827 questões
Dados:
Considere que a constante dos gases ideais (R) seja igual a 8 J·mol-1·K-1 e que lnK = -
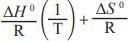
Com base nessas informações, é correto afirmar que:
Frasco A: REAÇÃO A : H2(g) + I2(g) ⇌ 2HI(g)
Frasco B: REAÇÃO B: 2NO2(g) ⇌ 2NO(g) + O2(g)
Considere os gases como ideias.
Se o volume de cada frasco for reduzido para um terço do volume inicial, é possível observar que:
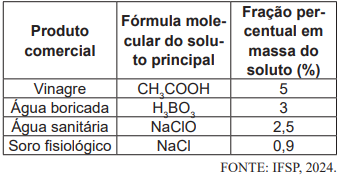
Uma pessoa possui, em sua casa, exatamente 100 mL de cada um dos produtos comerciais da tabela acima. Considerando os valores da fração percentual em massa do soluto na tabela acima, que a densidade de todas as soluções químicas é de 1,0 g mL-1 e que as soluções são formadas exclusivamente pelo soluto principal presente em água, escolha a alternativa que representa a menor concentração molar (mol L-1) do soluto em água.
Dados: H = 1,0 g mol-1; B = 10,8 g mol-1; C = 12,0 g mol-1; O = 16,0 g mol-1; Na = 23,0 g mol-1; Cl = 35,5 g mol-1
Fonte: SOUZA, Cleuzane R.; SILVA, Fernando C. Discutindo o contexto das definições de ácido e base. Química Nova na Escola, v. 40, n. 1, p. 14-18, 2018.
Considerando as informações do texto e a definição de Lewis para o conceito de ácido e base, analise os compostos indicados na tabela a seguir e assinale a alternativa correta:

Quanto às soluções, julgue o item seguinte.
Ocorre uma reação de precipitação quando iodeto de chumbo (PbI2) e nitrato de potássio (KNO3) reagem formando nitrato de chumbo (Pb(NO3)2) e iodeto de potássio (KI) sólidos, através da equação apresentada a seguir.
PbI2 (aq) + 2 KNO3 (aq) → Pb(NO3)2 (s) + 2 KI (s)
Quanto às soluções, julgue o item seguinte.
Um composto molecular dissolve‑se em água
formando, invariavelmente, moléculas carregadas
eletricamente (íons) dispersas pela solução, formando
um eletrólito.
Quanto às soluções, julgue o item seguinte.
Quando em solução aquosa, os íons positivos
provenientes de um sólido iônico (cátions) são atraídos
pelo lado negativo da molécula da água, enquanto os
íons negativos (ânions) são atraídos pelo lado positivo.
Quanto às soluções, julgue o item seguinte.
Quando o cloreto de sódio (NaCl) se dissolve em água,
cada íon separa‑se da estrutura cristalina e dispersa‑se
pela solução, ou seja, o sólido iônico dissocia‑se em
seus íons constituintes à medida que se dissolve.
A respeito dos ácidos, bases, sais e óxidos, julgue o item seguinte.
Os óxidos iônicos binários são compostos formados
por oxigênio e por mais dois outros elementos
químicos, sendo sua fórmula apresentada por esses
elementos precedidos pelo símbolo do oxigênio.
A respeito dos ácidos, bases, sais e óxidos, julgue o item seguinte.
Presente na água da chuva, o dióxido de carbono (CO2) reage com a água formando ácido carbônico (H2CO3), conforme a equação química apresentada a seguir.
CO2 (g) + H2O (l) → H2CO3 (aq)
A respeito dos ácidos, bases, sais e óxidos, julgue o item seguinte.
A base de Brønsted‑Lowry é uma espécie química
capaz de receber um ou mais prótons. Essa teoria leva
em conta vários compostos com caráter básico que
não liberam o íon hidroxila, quando dissolvidos em
solução aquosa.
Acerca das transformações da matéria, julgue o item seguinte.
Em uma reação de neutralização, quando uma substância ácida e uma substância básica são misturadas, obtêm‑se, como produtos, sal e água, conforme apresentado pela equação química a seguir.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
O Sulfato de Ferro heptahidratado é empregado como
parte integrante de um fertilizante hidrossolúvel
disponível no mercado para uso em adubação foliar,
fertirrigação ou aplicação direta no solo. Uma amostra
desse fertilizante foi submetida à análise físico-química,
na qual o profissional utilizou o Sulfato de ferro (II)
heptahidratado sólido, de grau analítico, fornecido pela
marca Merck, como padrão de referência. A massa molar
aproximada dessa substância é: