Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 1.859 questões
Um químico tem acesso a um vidro âmbar contendo HCl 0,1 M. Isso significa que essa solução contém:
Qual é o nome do ânion poliatômico SO42−?
Qual das seguintes alternativas descreve corretamente a diferença entre os conceitos de ácidos e bases de Brønsted-Lowry e de Lewis?
A concentração das espécies químicas em soluções é fortemente influenciada pelo grau de ionização ou dissociação dos solutos. Analise as seguintes assertivas sobre os conceitos mencionados:
I. Ácidos fortes como HCl e HNO3 são eletrólitos fortes.
II. A constante de ionização (Ka) de um ácido fraco não varia com a temperatura.
III. Para um ácido fraco, a adição de um sal contendo o íon comum reduz o grau de ionização do ácido devido ao efeito do íon comum.
IV. Bases fracas como KOH são eletrólitos fracos.
Quais estão corretas?
Uma indústria de cosméticos optou por monitorar a condutividade de sua água purificada mediante utilização de um condutívimetro, um equipamento que mede a condutância de soluções. Sobre essa técnica, assinale a alternativa INCORRETA:
Sobre a viscosidade, leia as afirmativas abaixo e assinale a alternativa CORRETA.
Compreender as funções inorgânicas é essencial para compreender a química e suas aplicações práticas, desde a manutenção do equilíbrio ácido-base no corpo humano até processos industriais de grande escala.
A respeito das funções inorgânicas, julgue as afirmativas abaixo, indicando V para VERDADEIRO e F para FALSO:
( ) De acordo com a teoria ácido-base de Brönsted-Lowry, os ácidos são reconhecidos por sua capacidade de doar prótons em solução aquosa, enquanto as bases têm a capacidade de aceitar prótons.
( ) Os sais são compostos formados pela reação entre um ácido e uma base.
( ) Os sais possuem ligações iônicas e covalentes.
( ) Os óxidos são compostos formados pela ligação do oxigênio com outro elemento menos eletronegativo.
( ) Os ácidos são classificados como sendo oxiácidos e hidrácidos.
Qual das seguintes alternativas apresenta a sequência CORRETA?
A função inorgânica ácido é fundamental na química, sendo caracterizada pela capacidade de doar prótons em solução aquosa. Os ácidos são amplamente utilizados em diversos contextos, desde aplicações industriais até processos biológicos. Em termos de nomenclatura, compreender seus diferentes nomes é essencial para identificar corretamente essas substâncias na prática química.
Entre os ácidos: HClO3, HClO2, HClO4 e HClO, assinale a alternativa CORRETA que corresponde a nomenclatura de cada ácido, respectivamente.
O vinagre é o produto resultante da fermentação de certas bebidas alcoólicas, particularmente do vinho. Na fermentação do vinho, micro-organismos da espécie Micoderma aceti transformam o álcool etílico em ácido acético. Após a fermentação, o vinho fica com cerca de 4 a 6 % de ácido acético, recebendo então o nome de vinagre (vinho azedo). O teor de ácido acético no vinagre é determinado volumetricamente titulando-se certa quantidade de vinagre com uma solução padrão de hidróxido de sódio (NaOH) 0,1 M. Suponha que em um Erlenmeyer de 100 mL se adicionou 2 mL de uma amostra de vinagre e após o processo de titulação, feito em triplicata, foram gastos os seguintes volumes de NaOH, V1: 16,7 mL; V2: 16,6 mL; V3: 16,8 mL.
% acidez em ácido acético: (𝑉𝑚𝑥𝑀𝑥100𝑥0,06)/𝐴; onde Vm é o volume médio gasto de NaOH em mL, M é a molaridade do NaOH em mol/L e A é o volume de amostra em mL.
A respeito do tema, julgue as afirmativas abaixo indicando V para verdadeiro e F para falso.
( ) A fenolftaleína é utilizada como indicador, indicando o final da reação, quando todo o ácido presente for neutralizado pelo hidróxido de sódio.
( ) O hidróxido de sódio é o agente titulante, o qual neutraliza o ácido presente na amostra em análise.
( ) O hidróxido de sódio 0,1 M deverá ser manipulado na capela de exaustão por conta de sua volatilidade.
( ) Ao final do processo de titulação o conteúdo do Erlenmeyer deve ser descartado em bombona de inorgânico halogenado.
( ) Após a titulação do vinagre foi obtido um teor de acidez em ácido acético de 5%.
Qual das seguintes alternativas apresenta a sequência CORRETA?
A compreensão dos conceitos de ácidos e bases é fundamental para a química e tem sido moldada por diferentes teorias ao longo do tempo. A teoria de Arrhenius, proposta no final do século XIX, define ácidos como substâncias que liberam íons de hidrogênio (H+) em solução aquosa e bases como substâncias que liberam íons hidroxila (OH-) em solução aquosa. Em contrapartida a teoria de Bronsted-Lowry, desenvolvida em 1923, ampliou essa definição ao considerar ácidos como doadores de prótons e bases como receptores de prótons, independente da presença de água. Ambas as teorias são fundamentais para o entendimento das propriedades ácido-base e são aplicadas em diversos campos da química.
A seguir, observe as reações:
Em relação a Teoria de Bronsted-Lowry e as reações dadas anteriormente, julgue as afirmativas abaixo como V para verdadeiro e F para falso.
( ) Nas reações I, III e IV o NH+ 4, H2O e HSO-4, respectivamente, são ácidos.
( ) Ambas as reações II e III possuem o mesmo ácido, mas com base conjugada diferente.
( ) A reação V apresenta H3O+ como ácido e HSO-3 como base.
( ) A reação I tem como ácido CN- , ácido conjugado o HCN e a base conjugada NH3.
( ) Dentre as cinco reações, há uma entre elas com o OH- como sendo seu ácido conjugado.
Qual das seguintes alternativas apresenta a sequência CORRETA?
É frequente o uso de açúcar (sacarose, C12H22O11) como ingrediente em sucos, refrigerantes, chás e muitos outros produtos, a fim de adoçar e, consequentemente, tornar seu sabor mais atrativo e agradável. Porém, é importante saber que o seu consumo em excesso pode estar associado a diversos problemas de saúde, como a obesidade, diabetes e doenças cardiovasculares. Suponha que o rótulo de um chá gelado (250 mL), de uma determinada marca, mostra em seus ingredientes que há 2 g de sacarose. O cliente, não muito satisfeito com o sabor doce, resolveu adicionar 20 mL de água em seu copo que já continha 80 mL do chá comercial. Diante do exposto, calcule a concentração em mol/L de sacarose no chá gelado comercial e a concentração em g/L de sacarose no seu copo após adição de água.
Dados: C: 12 u, H: 1 u, O: 16 u.
Assinale a afirmativa CORRETA que apresenta a concentração em mol/L de sacarose no chá gelado comercial e a concentração em g/L de sacarose no copo do cliente, respectivamente.
Dados: Constante de produto de solubilidade (KPS) para o Ni(OH)2 = 1 x 10-18 Constante de autoionização da água: Kw = 1,0 x 10-14
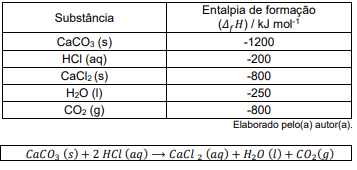
Dadas as entalpias de formação das substâncias listadas na tabela e considerando a equação acima, qual o valor da entalpia de reação para a reação, em kJ mol-1?
Um técnico necessita preparar uma solução contendo ácido clorídrico e ácido acético em mistura, com concentrações de 0,05 mol/L e 0,06 mol/L, respectivamente.
No laboratório, ele dispõe de água destilada e um balão volumétrico de 500 mL, além das demais vidrarias necessárias. No almoxarifado, ele dispõe de soluções cujos rótulos estão representados abaixo.
Dados:
Massa molar do ácido clorídrico: 36,5 g/mol
Massa molar do ácido acético: 60 g/mol
Qual das opções a seguir apresenta os volumes corretos de cada ácido que o técnico deve usar para que obtenha a solução de que precisa?
Leia o texto para responder às questões de 32 a 34. Ao ser contratado, o técnico observou que foram acumulados, no laboratório, vários frascos com resíduos químicos que devem ser tratados e/ou encaminhados para descarte correto. Consultando uma central de resíduos já estabelecida, ele encontrou algumas informações que poderiam auxiliar nesse processo. Por exemplo, soluções aquosas de sais inorgânicos de metais alcalinos e alcalinos terrosos: NaCl, KCl, CaCl2, MgCl2, Na2SO4, MgSO4 e tampões PO43-, não contaminados com outros produtos, devem ser diluídos e descartados diretamente na rede de esgoto. Soluções de ácidos ou bases inorgânicas: H2SO4, HCl, H3PO4, HNO3, KOH, NaOH, Na2CO3, K2CO3, NaHCO3, KHCO3. devem ser diluídas e neutralizadas, podendo, então, serem desprezadas na rede de esgoto, desde que não contaminadas com outros produtos.
A primeira etapa foi a identificação dos frascos buscando segregar os resíduos que são passíveis de destruição /neutralização no próprio laboratório, para posterior descarte na pia. Três frascos foram separados, pois se enquadravam nessa situação. Eles estavam classificados como descrito abaixo:
Frasco | Quantidade | Composição sugerida |
1 | 9,6L | Resíduo da reação de H2SO412 mol L-1 com Magnésio metálico e água de lavagem. |
2 | 12,4L | Solução de Bicarbonato de sódio (NaHCO3) e Ácido clorídrico (HCl). |
3 | 11,2L | Resíduo de KOH 6 mol L-1 com água de lavagem. |
Prezando pela segurança, este técnico buscou confirmar o máximo de informações apresentadas nesses rótulos, antes de proceder a qualquer tratamento. Assim, ele realizou alguns ensaios com amostras dos resíduos de forma a verificar aspecto físico, coloração, presença de precipitados, pH e ainda testes qualitativos para íons.
Disponível em: <https://www.sgas.ufscar.br/degr/residuos/residuos-quimicos/tratamento-no-laboratorio> (Com adaptações). Acesso em: 17. Abr. 2024.
A composição indicada nos rótulos aponta que o frasco 1 contém uma substância ácida, a solução do frasco 2 apresenta um sal neutro enquanto a solução do frasco 3 apresenta uma substância de caráter básico.
Dentre as alternativas, qual apresenta uma substância ácida, neutra e básica, respectivamente, de acordo com a teoria ácido-base de Bronsted?
Leia o texto para responder às questões de 32 a 34. Ao ser contratado, o técnico observou que foram acumulados, no laboratório, vários frascos com resíduos químicos que devem ser tratados e/ou encaminhados para descarte correto. Consultando uma central de resíduos já estabelecida, ele encontrou algumas informações que poderiam auxiliar nesse processo. Por exemplo, soluções aquosas de sais inorgânicos de metais alcalinos e alcalinos terrosos: NaCl, KCl, CaCl2, MgCl2, Na2SO4, MgSO4 e tampões PO43-, não contaminados com outros produtos, devem ser diluídos e descartados diretamente na rede de esgoto. Soluções de ácidos ou bases inorgânicas: H2SO4, HCl, H3PO4, HNO3, KOH, NaOH, Na2CO3, K2CO3, NaHCO3, KHCO3. devem ser diluídas e neutralizadas, podendo, então, serem desprezadas na rede de esgoto, desde que não contaminadas com outros produtos.
A primeira etapa foi a identificação dos frascos buscando segregar os resíduos que são passíveis de destruição /neutralização no próprio laboratório, para posterior descarte na pia. Três frascos foram separados, pois se enquadravam nessa situação. Eles estavam classificados como descrito abaixo:
Frasco | Quantidade | Composição sugerida |
1 | 9,6L | Resíduo da reação de H2SO412 mol L-1 com Magnésio metálico e água de lavagem. |
2 | 12,4L | Solução de Bicarbonato de sódio (NaHCO3) e Ácido clorídrico (HCl). |
3 | 11,2L | Resíduo de KOH 6 mol L-1 com água de lavagem. |
Prezando pela segurança, este técnico buscou confirmar o máximo de informações apresentadas nesses rótulos, antes de proceder a qualquer tratamento. Assim, ele realizou alguns ensaios com amostras dos resíduos de forma a verificar aspecto físico, coloração, presença de precipitados, pH e ainda testes qualitativos para íons.
Disponível em: <https://www.sgas.ufscar.br/degr/residuos/residuos-quimicos/tratamento-no-laboratorio> (Com adaptações). Acesso em: 17. Abr. 2024.
O técnico separou 200 ml de cada frasco para analisar. Após análise, o frasco 3 indicou uma concentração de 4,3mol L-1 de KOH e a ausência de contaminantes, podendo apenas neutralizar e descartar a solução na pia. Dentre as opções disponíveis e menos dispendiosas, o técnico optou por um resíduo de HCl 1,5 mol L-1 que tinha sido gerado e que também precisava ser descartado.
Considerando os volumes e as concentrações apresentados, qual alternativa apresenta o volume mais próximo do necessário para neutralizar totalmente os 11 litros restantes da solução de KOH?