Questões de Concurso
Comentadas sobre substâncias e suas propriedades em química
Foram encontradas 383 questões
TE (H2O) = +100 °C TE (H2S) = −60 °C
Essas diferenças entre as temperaturas de ebulição das substâncias podem ser explicadas pela(o)
Em relação ao processo de separação assinale (V), para as afirmativas verdadeiras, e (F), para as falsas.
( ) Na separação por precipitação, todos os precipitados formados precipitam rapidamente. ( ) Os compostos com íon cloreto são sempre solúveis, não sendo adequados para separação por precipitação. ( ) A separação por extração é estabelecido por um equilíbrio governado pela lei de distribuição do analito entre duas fase líquidas miscíveis. ( ) Na separação de íons metálicos, podem ser utilizados agentes quelantes, para formar complexos neutros altamente solúveis em água e praticamente insolúveis em solventes orgânicos.
A sequência correta, de cima para baixo, é
figura apresenta um esquema dos processos envolvidos no tratamento de água.
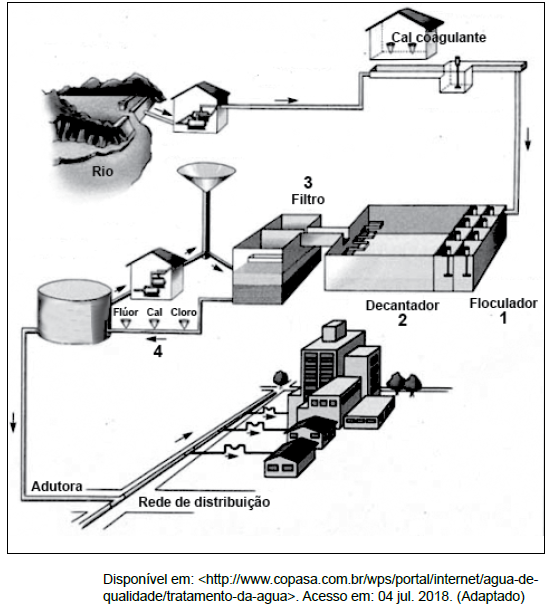
Sobre esse processo, é CORRETO afirmar que, na etapa
Considere a charge a seguir para responder a esta questão.

Ao pesquisar sobre o assunto, Calvin descobre que o gelo flutua na água, porque as partículas do gelo
O quadro apresenta densidades para água, solução salina e quatro plásticos diferentes.
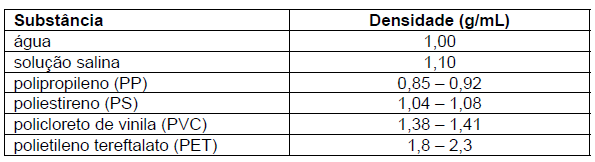
O comportamento CORRETO de cada um desses plásticos em água e solução salina é
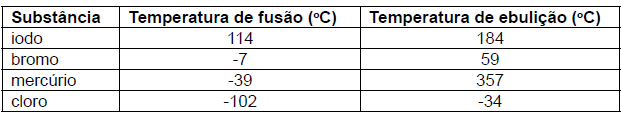
Rússia, país sede da Copa do mundo em 2018, apresentou uma temperatura média de 20oC durante os jogos. Nessa temperatura, é CORRETO afirmar que o
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
A troca iônica é um processo no qual os íons presos em
uma resina trocadora de íons (um sólido poroso
insolúvel) são trocados por íons presentes em uma
solução que é levada ao contato com o sólido. Resinas
trocadoras de íons têm aplicação no processo de
desionização de água, na purificação de soluções e na
separação de íons.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
A cromatografia é um método que permite a
identificação e a determinação de componentes em
misturas complexas, com base nas diferenças de
velocidade em que são transportados por meio de uma
fase móvel sólida, líquida ou gasosa. Na cromatografia
gás‐líquido, um gás transporta a amostra sobre uma fase
sólida estacionária, com a adsorção dos componentes
separados em diferentes graus.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
ma substância cujas soluções aquosas contêm íons é
chamada de eletrólito. Uma substância que não forma
íons em solução é chamada não eletrólito. Por exemplo,
as diferenças entre soluções contendo cloreto de sódio
e sacarose devem‐se, em grande parte, ao fato de o NaCl
ser iônico, enquanto o C12H22O11 é molecular.
A descrição sobre a pedra filosofal, abaixo, foi feita pelo alquimista espanhol o século XVI, Arnoldo de Villanova
“Existe na Natureza certa substância pura que, quando descoberta e levada pela Arte a seu estado perfeito, converterá à perfeição todos os corpos perfeitos em que tocar.”
Fonte: Manual da Química.
Marque a alternativa que contém um exemplo de uma substância pura:
I – água potável com sal e água destilada com gelo. II – água com óleo de soja e água destilada. III – água barrenta e água com gelo.
A formação da chuva está relacionada às mudanças de estado físico da água.
Considere as seguintes afirmativas referentes às mudanças de estado físico da água.
I – Condensação é a mudança da substância, do estado gasoso para o estado líquido.
II – Evaporação é a mudança da substância, do estado líquido para o estado gasoso.
III - Fusão é a mudança da substância, do estado sólido para o estado gasoso.
IV – Solidificação é a mudança da substância, do estado sólido para o estado líquido.
São verdadeiras, apenas, as seguintes afirmativas:
Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
1. Forças de London. 2. Ligação de hidrogênio. 3. Dipolo-dipolo.
( ) H2S ( ) NH3 ( ) I2
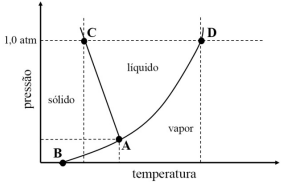
Considerando o gráfico precedente, que ilustra o diagrama de fases
para um composto molecular puro, assinale a opção correta.