Questões de Concurso
Sobre substâncias e suas propriedades em química
Foram encontradas 1.458 questões
( ) Os orbitais não-ligantes têm influência na estabilidade da molécula. ( ) A ordem de ligação no íon He2+ é 1. ( ) O arranjo e a geometria molecular do SnCl3- é tetraédrico e piramidal trigonal, respectivamente. ( ) O arranjo e a hibridização do átomo central em hexafluoreto de enxofre é octaédrico e sp3d2 , respectivamente.
A sequência está correta em
A ______ é a propriedade mecânica que permite metais sofrerem deformações tanto a quente quanto a frio, possibilitando a transformação em chapas com espessuras finas sem sofre rupturas.
A ______ é a capacidade que um metal possui de se deformar ao sofrer ação de uma força, deformando-se sem se romper.
A ______ é a grandeza que mede a resistência ao risco ou abrasão.
Assinale a alternativa que preencha correta e respectivamente as lacunas.
- A molécula FNO possui o N como átomo central, uma ligação dupla entre o O e o N e uma ligação simples entre o N e o F. O N possui um par de elétrons isolados.
- O CO2 tem 2 átomos de oxigênio ligados ao átomo central e cada O possui 3 pares de elétrons isolados.
Assinale a alternativa correta sobre as estruturas das moléculas descritas acima.
Líquido Densidade (g/mL) benzeno 0,884 clorofórmio 1,477 éter dietílico 0,710 xileno 0,872
A água salgada do Mar Morto possui densidade igual a 1,240 kg/L, enquanto a da água pura pode ser considerada unitária.
A situação abaixo foi encontrada durante uma extração.
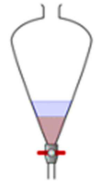
A camada superior e a camada inferior podem ser, respectivamente,
Em locais onde neva, é costume colocar sal (NaCl) sobre ruas e calçadas, pois facilita a fusão do gelo. Em um experimento de laboratório, os estudantes de uma classe de Química tentaram simular o que se observa, mas, nesse caso, comparando dois recipientes, um contendo gelo e sal, e outro, gelo e açúcar.
Analise as afirmativas a seguir em relação ao experimento dos estudantes.
I - Ambos os compostos usados dissolveram-se facilmente na água.
II - O sal foi mais eficiente no processo de fusão do gelo, pois um mol de NaCl tem o dobro de solutos do que um mol de açúcar.
III - O ponto de congelamento da água aumentou pelas interações entre ela e os solutos, em relação à água pura.
Está(ão) correta(s)
Na reação de iodeto de potássio e nitrato de chumbo, forma-se um sólido amarelo, que é o iodeto de chumbo, conforme a equação
2 KI (aq) + Pb(NO3)2
(aq) → 2 KNO3
(aq) + PbI2
(s)
A maneira correta de separar os produtos será por
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
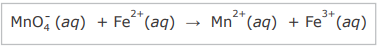
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
No que se refere a noções de tabela periódica, ligação química e estrutura molecular, julgue o item seguinte.
Na formação da molécula de dióxido de carbono (O=C=O),
observa-se que cada átomo termina ficando com o seu octeto
completo.
Em análises cromatográficas, a separação dos componentes da amostra é efetuada na coluna, em que a natureza do suporte sólido, o método de empacotamento, o comprimento, o diâmetro e a temperatura de operação são fatores importantes para obter-se a resolução desejada, com a respectiva identificação dos componentes pelo detector. Acerca desse assunto, julgue o item subsecutivo.
O espectrômetro de massas, um instrumento analítico que se
baseia nos fenômenos de ionização, é capaz de detectar
compostos presentes, como ultratraços, em nível de
picograma.
Em análises cromatográficas, a separação dos componentes da amostra é efetuada na coluna, em que a natureza do suporte sólido, o método de empacotamento, o comprimento, o diâmetro e a temperatura de operação são fatores importantes para obter-se a resolução desejada, com a respectiva identificação dos componentes pelo detector. Acerca desse assunto, julgue o item subsecutivo.
Em cromatografia gasosa, a análise de ultratraços de metais,
no nível de picograma, requer detectores muito sensíveis,
como a célula de condutividade térmica.
Em análises cromatográficas, a separação dos componentes da amostra é efetuada na coluna, em que a natureza do suporte sólido, o método de empacotamento, o comprimento, o diâmetro e a temperatura de operação são fatores importantes para obter-se a resolução desejada, com a respectiva identificação dos componentes pelo detector. Acerca desse assunto, julgue o item subsecutivo.
Quando a separação cromatográfica é realizada em um modo
de fase normal, a fase estacionária é um hidrocarboneto
apolar; ao passo que, quando é feita em um modo de fase
reversa, a superfície da fase estacionária tem uma
característica polar.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
Em setembro de 2020, pesquisadores da Universidade de Cardiff, no Reino Unido, juntamente com o Instituto de Tecnologia de Massachusetts, nos Estados Unidos, anunciaram a possível descoberta de fosfina (PH3) na atmosfera de Vênus. A evidência de fosfina foi divulgada como um indicador de um novo processo inorgânico ou de atividade biológica microbiana em Vênus.
PH3 é uma molécula de geometria piramidal na qual as distâncias das ligações P−H são de 1,42 Å e os ângulos H−P−H são de 93,5°. Ela exibe um pequeno momento de dipolo, 0,58 D, em comparação com NH3 (1,47 D).
[Dados: Valores de eletronegatividade de Pauling: P: 2,19; H: 2,20.]
A esse respeito, assinale a afirmativa correta.
O dimetilsulfeto, por exemplo, apresenta baixa solubilidade em água, mas é capaz de reagir com oxidantes atmosféricos na superfície de uma gotícula de água formando dimetilsulfóxido, que penetra na gotícula e continua na rota de oxidação até a formação de íons sulfato.
As gotículas de água e soluções aquosas dispersas na atmosfera são exemplos de dispersões classificadas como
