Questões de Concurso
Sobre substâncias e suas propriedades em química
Foram encontradas 1.458 questões

A geometria planar da molécula de amônia é responsável pelo seu elevado calor de vaporização.
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
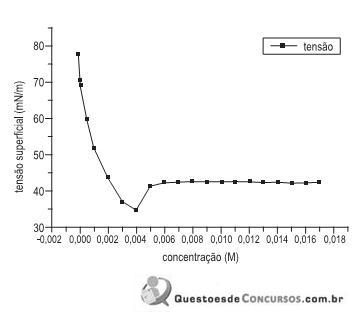
A figura acima apresenta dados experimentais de tensão superficial em função da concentração de surfactante (tenso-ativo) não iônico. Notam-se duas regiões distintas, uma de 0 a 0,003 M, e outra para concentrações acima de 0,005 M. A partir de uma análise, conclui-se que
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
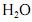 pode ser encontrada nas fases líquida, sólida ou vapor. Em uma única condição de pressão e temperatura, ela pode coexistir nesses três estados da matéria, ou fases, simultaneamente.
pode ser encontrada nas fases líquida, sólida ou vapor. Em uma única condição de pressão e temperatura, ela pode coexistir nesses três estados da matéria, ou fases, simultaneamente. Qual das substâncias apresentadas abaixo NÃO possui uma ligação covalente na sua estrutura?
Assinale a alternativa que apresenta a família e o período da Tabela Periódica em que está localizado o elemento cujos números quânticos do elétron mais energético do cátion monovalente são: n = 4, l = 2, m = + 2, s = + ½. Considere s = - ½ para o primeiro elétron do orbital.
O modelo RPECV (Repulsão de Elétrons da Camada de Valência) pode ser estendido a espécies que não satisfazem a regra do octeto, como espécies com geometria de octeto expandido. Dentre estas moléculas tem-se a molécula XeF6, um ácido de Lewis. Das afirmações abaixo que descrevem o XeF6, assinale a FALSA:
(Dados: 54Xe = [Kr]4d105s25p6 e 9F = 1s22s22p5)
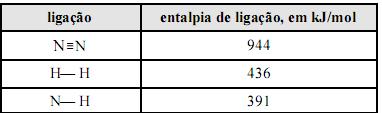
Quanto às ligações químicas, analise as assertivas abaixo:
I. Ligações covalentes não formam retículo cristalino.
II. Em ligações iônicas, ocorre transferência de elétrons.
III. As ligações iônicas e covalentes admitem ressonância.
IV. As ligações covalentes predominam nos compostos orgânicos.
V. As ligações iônicas formam compostos iônicos caracterizados por retículos cristalinos específicos.
Quais estão INCORRETAS?
Um elemento X apresenta a configuração 5s2 5p3 na camada de valência. Indique o grupo e a família desse elemento na tabela periódica:
Interações intermoleculares são ligações existentes entre diferentes moléculas em um meio. A chamada tensão superficial da água pode ser relacionada à ligação de hidrogênio. As moléculas que estão na superfície da água só realizam ligações de hidrogênio com moléculas situadas do lado ou na parte de baixo delas, isto provoca a contração do líquido, e cria uma força sobre as moléculas da superfície. Esta propriedade é muito importante, pois é a tensão superficial que controla certos fenômenos de superfície, sustentando a vida de comunidades de micro-organismos. Quanto às características da ligação de hidrogênio, assinale a alternativa correta.
A tabela periódica é um modo de organização dos elementos de forma a agrupar elementos com propriedades semelhantes, e permitir entender como diversas propriedades afetam os diversos elementos baseados na sua posição da tabela. De acordo com seus conhecimentos sobre a tabela periódica, assinale a alternativa incorreta:
Quanto às configurações eletrônicas, assinale a alternativa correta.
No que se refere à estrutura molecular, assinale a alternativa correta.
O conceito de ligação química foi criado para explicar a existência e a estabilidade de espécies químicas formadas por mais de um átomo. Assim, surgiram historicamente modelos teóricos que forneceram tal explicação e, entre eles, os modelos de ligação iônica, de ligação covalente, de ligação metálica e outros mais sofisticados, como a Teoria de Ligação de Valência e a Teoria Orbital Molecular. A respeito dos modelos iônico e covalente, assinale a alternativa correta.
Dados eventualmente necessários: massas molares (g/mol): A = 23; C = 12; O = 16; Cl = 35,5; H = 1.
I. Uma substância utilizada como padrão primário deve ser termicamente estável nas temperaturas necessárias para secá-la numa estufa.
II. Na titulação de uma solução ácida a ser padronizada, usando-se como padrão primário o bórax, ocorre, em solução aquosa, a neutralização da solução ácida pelo hidróxido de sódio.
III. O tetraborato de sódio decahidratado é um padrão primário alcalino, que, ao se dissolver em água destilada, por hidrólise, origina um sal de boro.
IV. Um sal higroscópico que reaja com dióxido de carbono do ar à temperatura ambiente é quimicamente ideal para ser utilizado como padrão primário.
São CORRETAS as afirmativas
I. Compostos metálicos são formados por arranjos de redes de núcleos de átomos de um determinado metal, formando uma parte interna positiva com os elétrons rodeando esse arranjo. II. O composto MgCl2 é um exemplo de ligação metálica. III. No composto orgânico ácido metanóico CH2O2, encontra-se as ligações do tipo covalente entre os compostos ligados ao carbono e ligação iônica entre um dos oxigênios e o hidrogênio. IV. O cloreto de vinila (cloroeteno) possui somente ligações covalentes.
Estão corretas as asserções: