Questões de Concurso
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 389 questões
• Substância X: Quando adicionada à água, torna o meio ácido e reage com carbonatos liberandogás carbônico.
• Substância Y: Quando em solução aquosa, libera íons OH-.
• Substância Z: É solúvel em água, não altera o pH da solução e pode ser obtida a partir da reaçãoentre uma base forte e um ácido forte.
• Substância W: É um sólido cristalino que reage com água formando uma solução básica.
Com base nos testes, assinale a alternativa que contém, correta e respectivamente, a classificação decada substância.
Sobre a determinação de pH, considerando a imagem a seguir, marque V para as afirmativas verdadeiras e F para as falsas.

( ) Os métodos indicados em A e B podem ser empregados para medidas quantitativas do pH em soluções em estudo com exatidão e precisão.
( ) A coloração amarela à avermelhada observada quando o método A é utilizado é indicativa de valores de pH ácido, enquanto a azulada é indicativa de valores de pH básico.
( ) O fundamento da determinação de pH pelo método A é a mudança de cor observada na solução em estudo devido à presença do indicador na fita.
( ) O método para determinar o pH indicado pela letra B é quantitativo e se baseia na concentração de íons H+ nas soluções em estudo.
( ) O método para determinar o pH de soluções em estudo indicado pela letra A é o de escolha para uso no controle de qualidade por ser rápido, fácil e barato.
( ) Pelo método que utilliza o aparelho indicado em B, é necessário que seja calibrado com, pelo menos, duas soluções tampão, ácida e básica, diariamente ou imediatamente antes da medida a ser realizada.
A sequência está correta em
1. Prender a bureta no suporte universal e completar com uma solução de H2SO4. Acertar o nível da solução na marca zero;
2. Com uma pipeta de 50 mL, pipetar esse volume de NaOH e adicionar no Erlenmeyer;
3. Adicionar 3 gotas de fenolftaleína ao Erlenmeyer, agitar e anotar a cor;
4. Colocar o Erlenmeyer sob a bureta e gotejar cuidadosamente a solução de H2SO4 no frasco, agitando-o constantemente;
5. Deixar gotejar até que a solução contida no Erlenmeyer mude de cor de forma permanente. Fechar a torneira imediatamente;
6. Ler na bureta o volume de H2SO4 gasto na titulação. Anotar o valor do volume de H2SO4. (Volume gasto de H2SO4 na titulação: 20 mL.)
A partir da realização de todas as etapas e das observações experimentais, analise as afirmativas a seguir.
I. A reação química entre o hidróxido de sódio e o ácido sulfúrico é 2 NaOH + H2SO4 → Na2SO4 + 2H2O.
II. A quantidade de matéria, em mols, de ácido sulfúrico presente no volume consumido no processo, é 0,02 mol.
III. Sendo a reação entre o ácido e a base completa, a concentração, em mol/L, da amostra de hidróxido de sódio, é 0,08 mol/L.
Está correto o que se afirma em
Baseado nessa teoria, quando adicionamos gás amônia na água, formando uma solução de hidróxido de amônio, é correto afirmar que
Qual a alternativa que contém um par conjugado ácido-base segundo a teoria protônica?
Al2O3(s) + 2NaOH (aq) + 3H2O(l) ↔ 2Na+ (aq) +2[AI(OH)4]- (aq)

De acordo com a resposta dos estudantes, analise as afirmativas a seguir.
I. Dentre as soluções dos três ácidos analisados, o ácido sulfúrico acende a lâmpada com maior intensidade.
II. Somente as soluções de sacarose e naftaleno não acendem a lâmpada.
III.Somente as soluções de sulfato de cálcio, etanol, ácido sulfúrico, ácido sulfídrico e ácido hipocloroso acendem a lâmpada.
Está correto o que se afirma em
I. Quando a água congela, as moléculas assumem o arranjo hexagonal aberto e ordenado. Esse arranjo otimiza as interações de ligação de hidrogênio entre as moléculas e cria uma estrutura menos densa para o gelo se comparada com a da água.
II. A densidade mais baixa do gelo comparada com a da água pode ser entendida em termos das interações de ligação de hidrogênio entre as moléculas de água.
III. Uma determinada massa de gelo ocupa maior volume que a mesma massa de água líquida.
Está correto o que se afirma em
Dados:
Considere que a constante dos gases ideais (R) seja igual a 8 J·mol-1·K-1 e que lnK = -
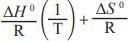
Com base nessas informações, é correto afirmar que:
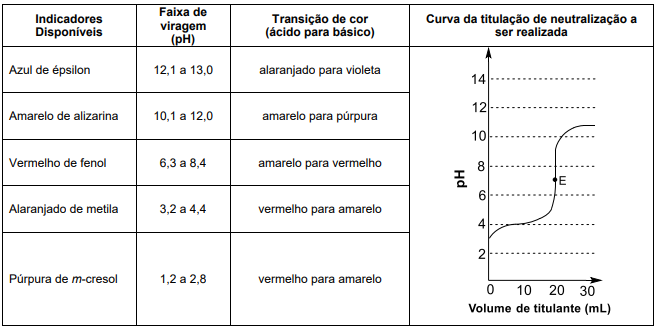
O indicador que o técnico deve utilizar é:
Uma solução de um composto molecular ioniza‑se dissolvido em água. É o caso, por exemplo, da solução de metanol (CH3OH), que é formada, majoritariamente, por íons H⁺ e íons CH3O⁻, com as moléculas dispersas por toda a solução.
Quando um sólido iônico é solubilizado em água, os íons em solução ficam rodeados por moléculas de água, sendo que a substância que forma essa solução aquosa é denominada eletrólito.
Quando um ácido de Brønsted‑Lowry transfere um próton para uma base, a substância produzida nessa transferência é chamada de base conjugada do ácido. Da mesma forma, quando uma base de Brønsted‑Lowry recebe um próton, é formada outra substância, denominada ácido conjugado da base.
Uma substância iônica tem condutividade elétrica baixa, seja no estado sólido, no estado líquido (quando fundida) ou quando dissolvida em solução aquosa, por causa da retenção de seus íons ao deslocamento em direção aos polos da fonte externa de corrente elétrica aplicada.