Questões de Concurso
Comentadas sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 72 questões
Os óxidos correspondem a uma classe de compostos que podem originar as bases e os ácidos, portanto são classificados de acordo com suas características ácido-base. Dentre os óxidos mais importantes, os NOx aparecem pela sua significância como poluentes atmosféricos. O NO2 e o NO são poluentes primários e o N2O, apesar de não ser um importante poluente da troposfera, acaba por exercer grande influência na estratosfera.
Considerando os óxidos em questão, na ordem apresentada no enunciado, indique a opção que relaciona corretamente a sua nomenclatura de óxido ao seu caráter ácido-base frente à reação com a água.
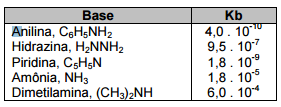
Analisando esses valores, é CORRETO afirmar:
Soluções aquosas dos sais cianeto de sódio (NaCN) e cloreto de
amônio (NH4C ) apresentam pH
) apresentam pH
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
No mecanismo apresentado, o A1C13 atua como um ácido de
Lewis.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 -5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A 25 °C, a porcentagem de dissociação do NH4OH em uma
solução 0,10 mol/L é superior a 1 %.
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
Se o gás carbônico reagir com a água para formar o ácido carbônico, o CO2 receberá um par de elétrons da água, que é uma base de Lewis.
2KNO3(s) + S(s) + 3C(s)-> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O -> 6 HNO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
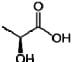
A acidez titulável é expressa em porcentagem ( (massa/volume ) de ácido lático, representado pela fórmula estrutural a seguir:
Em um ensaio, uma alíquota de 10 mL de amostra de leite e foi colocada em um erlenmeyer e adicionou-se duas gotas de fenolftaleína. A titulação da amostra consumiu 1,68mL-1 de solução de NaOH 0,100 mol.L -1 .
A acidez do leite na amostra, expressa em porcentagem, (massa/volume) é de
Dados: Massas molares: H= 1 g.mol –1 ; C= 12 g.mol –1 ; O= 16 g.mol –1 .