Questões de Concurso
Comentadas sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 95 questões
( ) Sommerfeld propõe que a energia do elétron seria determinada pela distância em que ele se encontra do núcleo e pelo tipo de órbita que descreve.
( ) Hantaro Nagaoka, em 1903, sugeriu um modelo atômico formado por pares de cargas positivas e negativas, aos quais chamou de “dinamidas”. E estes pares de cargas ficariam em blocos flutuantes no espaço.
( ) Em 1904, Philipp Lénard publicou no Japão uma descrição do carbono, bem moderna para época, ele sugeriu que o átomo era constituído de um anel de elétrons ao redor de um centro muito denso.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. São possíveis 9 combinações de moléculas de CO2 . II. A molécula mais leve é o que é encontrado em maior proporção. III. A molécula mais pesada encontrada é o 14C 18O2.
Assinale a alternativa correta .
I. O átomo de Ni possui um número atômico 28 e massa atômica 59, logo seu número de nêutrons é 28 pois é um átomo neutro. II. O Cl possui um número atômico de 17 e possui 2 isótopos naturais (35 e 37), logo seu número de nêutrons é de 18 e 20. III. O Cl- possui número atômico 17 e seus isótopos (35 e 37) possuem 16 e 18 nêutrons respectivamente. IV. O número de elétrons do Na+ é menor que o número de prótons de seu núcleo.
Estão corretas as asserções:
I. A configuração eletrônica do B (n=5) é 1s22s22p1 . II. A configuração eletrônica do V (n = 23) é 1s22s22p63s23p64s23d3 . III. A configuração eletrônica do Br (n = 35) é 1s22s22p63s23p64s23d104p5 .
Assinale a alternativa que contenha somente as asserções com a distribuição eletrônica correta.
O 60Co é isótono do nuclídeo
Dado: Número atômico do Mn = 25 Número atômico do Fe = 26 Número atômico do Co = 27 Número atômico do Ni = 28 Número atômico do Cu = 29

O íon acima representado possui:
Sobre as propriedades periódicas dos elementos, assinale a alternativa incorreta.
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
As letras W, X, Y e Z representam átomos de quatro elementos e suas distribuições eletrônicas.
As letras não correspondem aos símbolos dos elementos.
Relacione os elementos às suas respectivas características.
W – 2 : 4
X – 2 : 8 : 1
Y – 2
Z – 2 : 8 : 14 : 2
( ) Gás inerte menos denso que o ar.
( ) Reage com a água, produzindo uma base e gás hidrogênio, liberando grande quantidade de calor.
( ) Metal do quarto período da tabela periódica.
( ) Ametal típico das moléculas orgânicas.
Assinale a opção que mostra a relação correta, segundo a ordem apresentada.
Considere os átomos neutros X e Y, cujas distribuições eletrônicas são mostradas abaixo:
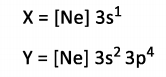
O composto formado por esses dois elementos é:
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como: