Questões de Concurso
Comentadas sobre teoria atômica: modelo atômico de dalton, thomson, rutherford, rutherford-bohr em química
Foram encontradas 77 questões
I. A configuração eletrônica do B (n=5) é 1s22s22p1 . II. A configuração eletrônica do V (n = 23) é 1s22s22p63s23p64s23d3 . III. A configuração eletrônica do Br (n = 35) é 1s22s22p63s23p64s23d104p5 .
Assinale a alternativa que contenha somente as asserções com a distribuição eletrônica correta.
A partir dessas novas leis foi possível determinar a(o)
Bohr postulou sobre a estrutura eletrônica de um átomo ao propor que a matéria é formada por átomos, partículas maciças e indivisíveis que não podem ser criadas nem destruídas. Nesse modelo, os átomos preservam sua identidade em todas as transformações, sendo impossível transformar um elemento químico em outro, o que se contrapõe às ideias dos alquimistas.
Como princípios da teoria atômica de Dalton, tem-se que os elétrons se movem ao redor do núcleo em um número limitado de órbitas bem definidas, que são denominadas órbitas estacionárias. Nessa órbita estacionária, o elétron não emite nem absorve energia.
Na origem do conhecimento químico, nas mais diferentes civilizações, há um grande número de tecnologias químicas, como aquelas relacionadas com a cocção, conservação com sal, produção de bebidas, além de extração, produção e tratamento de metais.
A alquimia consiste em um conjunto de práticas científicas padronizadas da Idade Média que buscavam a transformação de metais menos nobres em ouro; a transição das técnicas modernas da teoria científica da alquimia à química é reconhecida como a origem da química moderna.
A história da química pode ser plenamente observada sem se considerar a história da filosofia, da educação, das religiões e das artes, por se tratar de uma ciência distinta das demais em termos do seu desenvolvimento histórico.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
O íon Fe3+ (ZFe= 26) apresenta a mesma configuração
eletrônica que o íon Mn2+ (ZMn = 25).
O modelo atômico de Dalton foi adequado para explicar satisfatoriamente:
I. as leis ponderais de Lavoisier e Proust.
II. os experimentos de Faraday sobre eletrólise.
III. a radioatividade natural do elemento urânio.
Está correto o que consta APENAS de
No estado fundamental, a distribuição eletrônica dos átomos de enxofre corresponde a
1s2 2s2 2p6 3s2 3p4
Sabendo que ZPt = 78, julgue o item que se segue, acerca do complexo [Pt(NH3)2Cl2], cujas estruturas possíveis são mostradas nas figuras 1 e 2.
A configuração eletrônica do íon metálico do complexo em
apreço termina em um orbital d8
.
Julgue o item seguinte, relativos às propriedades periódicas.
A energia de ionização é aquela liberada quando um átomo
isolado no estado fundamental, em fase gasosa, recebe um
elétron.
O modelo de Dalton foi o primeiro modelo atômico quantizado.
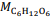 = 180 g/mol e
= 180 g/mol e 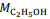 = 46 g/mol.
= 46 g/mol. A química distanciou-se da alquimia a partir dos ensaios de Robert Boyle, um dos primeiros pesquisadores a dar forma científica ao atomismo, opondo-se a Aristóteles e Paracelso.
“Um modelo científico é uma representação da natureza, uma imagem construída, que permite a compreensão de alguns fenômenos. Quando adequado, permite previsões acerca dos fenômenos estudados e torna possível a melhor compreensão da natureza. Por outro lado, quando um modelo não é capaz de explicar adequadamente determinados fenômenos, sua reformulação torna-se necessária.”
LISBOA, J. C.F. (org). Ser Protagonista. Química. 1ª edição. 2010.
O modelo atômico proposto por Rutherford foi capaz de explicar novas concepções do átomo, porém sua teoria não explica uma questão fundamental.
Qual ponto fundamental NÃO é definido por Rutherford?
