Questões de Concurso
Comentadas sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 82 questões
I - Em um processo isotérmico, a variação da energia interna de um gás ideal é zero.
II - A entropia do universo sempre aumenta em processos espontâneos.
III - A variação da energia livre de Gibbs é igual ao trabalho máximo não-expansivo que pode ser realizado por um sistema à temperatura e pressão constantes.
IV - Para qualquer processo em um sistema isolado, a variação de entropia é sempre maior que zero.
V - A entalpia de uma reação endotérmica é sempre positiva.
É CORRETO concluir o que se afirma em:
Um dos métodos mais comuns envolve a oxidação do metal cobre em presença de ar. São conhecidas a 298K, as seguintes entalpias e entropias a T e P constantes:

Em relação ao óxido de cobre, assinale a afirmativa correta.
Em relação aos processos de tratamento de lodos ativados e digestores anaeróbicos, assinale a afirmativa correta.
Com base nessas informações assinale a afirmativa correta acerca da espontaneidade do processo e da variação de energia livre de Gibbs ΔG.
2NO2(g) ⇌ N2O4(g) ΔH = - 57 kJ/mol
Durante o processo, observou-se que a cor do sistema se torna menos intensa em determinadas condições, indicando uma mudança na concentração dos compostos. A empresa deseja maximizar a formação de N2O4 e, para isso, é necessário realizar ajustes precisos nas condições de equilíbrio. Considerando o exposto e os princípio de Le Chatelier, assinale a afirmativa correta.
I. Nas células eletrolíticas, a energia química é convertida em energia elétrica.
II. Assim como a entropia, processos espontâneos são acompanhados por uma variação positiva na energia de Gibbs (∆G).
III. Ao multiplicar por dois a semirreação “Fe2+(aq) → Fe3+(aq) + e- ; E°= – 0,77V”, o valor do potencial padrão não deverá ser alterado.
Está correto o que se afirma apenas em
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do trecho acima.
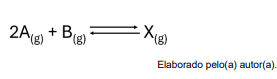
Segundo o principío de Le Chatelier, a alteração no sistema que deve ser feita para que equilíbrio favoreça a formação de reagentes é
Caso o petróleo extraído de um poço esteja armazenado em um tanque metálico por um tempo longo e suficiente para que esse petróleo esteja em equilíbrio térmico com as paredes do tanque e o meio externo, então, nessa situação, não haverá trocas de energia térmica entre o petróleo e o meio externo.
Uma estratégia que permite retirar as tampas metálicas de conservas de vidro é o resfriamento da tampa, se o coeficiente de dilatação linear da tampa metálica for superior ao do vidro.
“A energia livre de Gibbs é uma grandeza termodinâmica notável”. A entropia é considerada uma função de estado assim como a entalpia. Considerando a síntese da amônia a partir de N2(g) e H2(g) a 298 K conforme equação a seguir:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 702)
N2(g) + 3 H2(g) → 2 NH3(g)
E conhecendo as informações do quadro abaixo:
Substância |
ΔHºf(kJ.mol-1) |
Sº (J.mol-1.k-1) |
N2(g) |
0 |
191,5 |
H2(g) |
0 |
130,6 |
NH3(g) |
–80,3 |
111,3 |
Podemos afirmar, com base nos dados apresentados, que o valor da variação da energia livre de Gibbs para a síntese da amônia, em kJ.mol-1, é aproximadamente:
https://www.ecycle.com.br/bom-ou-ruim-usado-como-conservante-em-vinhos-dioxido-de-enxofrepode-causar-reacoes-alergicas/ (adaptado) acessado:2109/2023.
Ao se atacar 1,04 kg de sulfito de magnésio, com ácido clorídrico, qual o volume de anidrido sulfuroso obtido a 27°C e 1869 mmHg?
Em um laboratório, foram realizadas quatro réplicas de uma análise de cromo em uma liga metálica, obtendo-se os seguintes valores: 14 mg g-1 , 10 mg g-1 , 16 mg g-1 e 12 mg g-1 .
Para esse conjunto de dados, o desvio-padrão, em mg g-1 , encontra-se na faixa entre
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
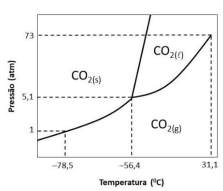
(*diagrama não desenhado em escala)
A partir das informações apresentadas avalie se as afirmativas a seguir são verdadeiras (V) ou falsas (F).
( ) Sob a condição de 5,1 atm e –56,40C prevalece o equilíbrio entre as fases sólida e gasosa.
( ) Sob a condição de 1,0 atm e –78,50C ocorre o ponto crítico para dióxido de carbono.
( ) Sob a condição de 73,0 atm e 31,1 atm ocorre o ponto de sublimação do dióxido de carbono.
As afirmativas são, respectivamente,