Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 225 questões
Considere uma pessoa adulta, em repouso, com um gasto energético de 2000 kcal e consumo de 2500 kcal em um dia, na forma de alimentos. Suponha, também, que 70% do seu peso corporal de 80 kg vem da água que constitui seu corpo. Calcule a energia, em kcal, que o corpo humano teria em excesso se, além do repouso, a temperatura da água corporal aumentasse de 36,5 para 38 °C:

Acerca da termoquímica, da espontaneidade de reações e da ação de catalisadores, julgue o item a seguir.
Um catalisador é uma substância que aumenta a
velocidade de uma reação sem ser consumida durante
ela. Um catalisador é homogêneo se está presente em
uma fase diferente da dos reagentes e é heterogêneo se
está presente na mesma fase dos reagentes.
Acerca da termoquímica, da espontaneidade de reações e da ação de catalisadores, julgue o item a seguir.
Pela Lei de Hess, uma entalpia de reação é a soma das
entalpias de qualquer sequência de reações, quando
realizadas nas mesmas condições de temperatura e
pressão, em que a reação total pode ser dividida.
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
O gás natural tem um poder calorífico superior de:
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
A termoquímica permite calcular a energia liberada na forma
de calor por uma reação, considerando-se valores de energia
para ligações químicas.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
A entalpia não informa se uma reação é espontânea ou não.
Dados: CH₄ + 20₂ → C0₂ + 2H₂0
Variação de entalpia: ΔH = 2800 kj/mol
Massas atômicas relativas: C = 12 H = 1
A nitroglicerina é um líquido oleoso de cor amarelo-pálido, muito sensível ao impacto. É um dos explosivos mais fortes que existem. Sua decomposição ocorre conforme mostra a equação a seguir:

Sobre os possíveis motivos que justificam seu alto poder explosivo, foram feitas as seguintes
afirmações:
I. A energia de ligação entre os átomos de Nitrogênio, assim como entre C e O e entre H e O, são muito fortes.
II. Os produtos gasosos aumentam a pressão, consequentemente, seu poder destrutivo.
III. O aumento do grau de desordem do sistema torna a equação altamente favorável, em acordo com a segunda lei da termodinâmica.
IV. Processos endotérmicos liberam grande quantidade de energia.
Atenção: A questão refere-se ao conteúdo de Noções de Gás Natural.
Em comparação ao Gás Liquefeito de Petróleo − GLP, o gás natural tem uma maior capacidade de se dissipar na atmosfera. Isso se deve, basicamente
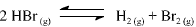
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
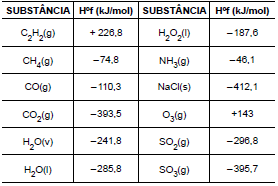
Considere as seguintes entalpias padrões, 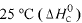
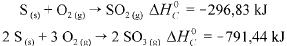
Com base nessas informações, julgue o item que se segue.
A entalpia padrão da reação 2 SO2(g) + O2(g) → 2 SO3(g), a 25
°C ,é igual a -197,78 kJ.
I) CO2(g) → C(grafite) + O2(g) ΔH1 = 94 kcal
II) H2(g) + 1/2O2(g) → H2O(l) ΔH2 = – 78 kcal
III) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH3 = – 222 kcal
IV) C(grafite) + 2H2(g) → CH4(g) ΔH4 = ?
Com base nessas informações,