Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 334 questões
CaCO3 (s) → CaO (s) +CO2 (g) ΔH=+178kJ/mol
Com base nessa reação e nos conceitos de termoquímica, analise as assertivas abaixo:
I. Como a reação é endotérmica, a energia dos produtos é maior do que a energia dos reagentes.
II. Se 2 moles de carbonato de cálcio forem decompostos, a energia absorvida será de 356 kJ.
III. A decomposição do carbonato de cálcio será favorecida a baixas temperaturas, segundo o princípio de Le Chatelier.
IV. Se essa reação ocorresse no sentido inverso, o ΔH seria -178kJ, caracterizando uma reação exotérmica.
Quais estão corretas?

A partir das entalpias de formação, qual a entalpia de combustão do metano?
1. Oxidação da amônia para formar óxido nítrico.
2. Oxidação do óxido nítrico para formar dióxido de nitrogênio.
3. Dissolução do dióxido de nitrogênio em água para formar ácido nítrico.
Considerando essas reações, um rendimento global de 85% em todo o processo, e massas molares dos elementos H: 1,01 g/mol, N: 14,01 g/mol e O: 16,00 g/mol; a massa de amônia necessária para produzir 1 kg de ácido nítrico é de aproximadamente:
C2H2(g) + O2(g)⟶ CO2(g)+ H2O(g)
Sabendo que a combustão de 1 mol de acetileno libera aproximadamente 1300 kJ de energia, a quantidade de calor liberada na combustão completa de 52 g de acetileno é de aproximadamente
I. É uma propriedade extensiva. Portanto, a magnitude do ∆H é diretamente proporcional à quantidade de reagente consumida no processo.
II. A variação de entalpia para uma reação depende do estado dos reagentes e dos produtos.
III.A variação de entalpia para uma reação é igual em valores absolutos, mas oposta em sinais para o ∆H da reação inversa.
Está correto o que se afirma em
Na matriz energética nacional, a participação das fontes fósseis passou de 9% em 2000, para 14% em 2020. O crescimento se dá, principalmente, por dois fatores: aumento da demanda por energia, que não foi acompanhada pela oferta, e as repetidas crises hídricas no país.
(Adaptado de CNN, 02/07/2022)
Com relação às transformações de energia e às termoelétricas, analise os itens a seguir:
I. O combustível usado em uma usina termelétrica a gás natural é renovável, pois o biogás usado é oriundo da fermentação do lixo orgânico.
II. Em uma usina termoelétrica a gás natural, as transformações de energia são de química para térmica, desta para energia cinética e, por fim, para energia elétrica.
III. A energia não pode ser destruída, embora possa ser criada e transformada.
Está correto o que se afirma em
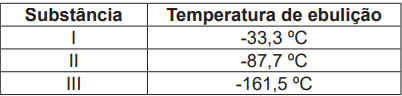
Fonte: ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p.191.
Considerando a relação existente entre as interações intermoleculares e a temperatura de ebulição, e comparando a temperatura de ebulição das três substâncias, assinale a alternativa que identifica, corretamente, a fórmula química das substâncias I, II e III. São dados os números atômicos dos elementos químicos H (Z=1), C (Z=6), N (Z=7) e P (Z=15).
Acerca das transformações da matéria, julgue o item seguinte.
As reações químicas que liberam a energia na forma
de calor são denominadas reações endotérmicas.
Já as reações que retiram o calor do ambiente são
denominadas reações exotérmicas.
A formação de amônia pode ser realizada pela reação entre o gás nitrogênio e o gás hidrogênio, conforme a equação química a seguir.
N2 (g) + H2 (g) → NH3 (g) ΔH = −92 kJ
Para essa reação, o valor negativo da variação de entalpia indica que a reação é fortemente endotérmica, com a liberação de 92 kJ de energia.
A quantidade de calor transferido de um objeto mais quente para outro mais frio independe da quantidade de material presente. Também não há qualquer dependência desse processo com a identidade do material que ganha e do material que perde calor.
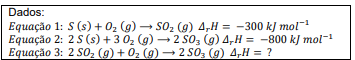
Um químico observa que, durante a dissolução de um certo sal em água, o recipiente em que a solução está sendo preparada se resfria.
A explicação química mais coerente para esse fenômeno é:
O metano (CH4) é um gás produzido durante o processo natural de digestão dos alimentos pelos rebanhos bovinos. A relevância desse gás, considerado fundamental na estratégia de mitigação do aquecimento global, se reflete no fato de o Brasil ter aderido ao Pacto Mundial do Metano na COP26, realizada na Escócia em 2021, se comprometendo a reduzir sua emissão.
Na combustão completa do metano, ele reage com oxigênio (O2) e produz gás carbônico (CO2) e água (H2O).
Disponível em: <https://www.embrapa.br/busca-de-noticias/-/noticia/73172252/nova-metodologia-mede-emissao-de-metano-em-reprodutores-bovinos#:~:text=equipamento%20no%20dorso),
Emiss%C3%A3o%20de%20metano%20%C3%A9%20decorrente%20do%20processo%20de%20digest%C3%A3o%20dos,digest%C3%A3o%20dos%20alimentos%20pelos%20animais>. (Com adaptações) Acesso em: 17 abr. 2024.
Dados:
Substância ΔHf0 (KJmol-1)
CH4(g) -74,8
CO2(g) -393,5
H2O(l) -285,8
Assinale a alternativa que apresenta o calor liberado pela combustão completa de oito gramas de gás metano.
Considere que a reação ocorre em condições padrão.
Leia o texto a seguir.
“Em química, entretanto, a maior parte das reações químicas ocorre em recipientes abertos para a atmosfera e, portanto, em pressão constante de cerca de 1 atm. Esses sistemas podem se expandir ou contrair livremente. Se um gás se forma, ele trabalha contra a atmosfera para ocupar espaço. Embora nenhum pistão esteja envolvido, trabalho é realizado. Nesse sentido, uma função de estado que medisse as variações de energia em pressão constante considerando automaticamente as perdas de energia como trabalho de expansão durante a transferência de calor seria muito útil.”
ATKINS, Peter; LAVERMAN, Leroy; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 7. Porto Alegre: Bookman, 2018. [Adaptado].
A função de estado à qual o trecho grifado no texto faz
referência é a