O calor liberado ou consumido em uma reação química é dado ...
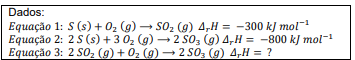
- Gabarito Comentado (1)
- Aulas (8)
- Comentários (1)
- Estatísticas
- Cadernos
- Criar anotações
- Notificar Erro
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
1ª Etapa - Inverter a equação 1, quando se inverte a equação troca o sinal.
SO2 = S + O2 deltaH = 300 kJ.mol-1
2ª Etapa - Multiplicar a equação 1 por 2.
2SO2 = 2S + 2O2 deltaH = 2x300 kJ.mol-1
Ou seja, as reações ficaram assim:
2SO2 = 2S + 2O2 deltaH = 600 kJ.mol-1
2S + 3O2 = 2SO3 deltaH = -800 kJ.mol-1
Somando-se as equações:
2SO2 + 2S + 3O2 = 2S + 2O2 + 2SO3 deltaH = 600 +(-800) = -200 kJ.mol-1
Reação final : 2SO2 + O2 = 2SO3 deltaH = -200 kJ.mol-1
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo