Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 228 questões
Com relação à termoquímica, à entropia, à espontaneidade de reações e à cinética química, julgue o item.
Pela lei de Hess, na mesma temperatura e na mesma
pressão, a entalpia de uma reação é a soma das entalpias
de qualquer sequência de reações em que a reação total
possa ser dividida.
Sabendo-se que os calores de formação da sacarose, do dióxido de carbono e da água são, respectivamente, 531 kcal/mol, 94 kcal/mol e 68,4 kcal/mol, o resultado obtido pelo perito foi de cerca de:
Sabendo-se que ΔHfo(H2O,L) = -285 kJ/mol, e que ΔHfo(Fe2O3,s) = -824 kJ/mol, o profissional determinou o calor de formação solicitado como sendo de aproximadamente:
Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
C2H2 (g) + 2 H2 (g) → C2 H 6 (g) HΔº= ?
Embora não tenha encontrado o valor do ΔH de hidrogenação dessa reação em tabelas, encontrou asseguintes entalpias-padrão de combustão:
C2H2 + 5/2 O2 (g) → 2 CO2 (g) + H2O (I) ΔHCº = - 1.301 kJ/mol C2H6 (g) + 7/2 O2 (g) → 2 CO2 (g) + 3 H2O (I) ΔHCº = - 1.561 kJ/mol H2 (g) + 1/2 O2 (g) → H2O (l) ΔHCº = - 286 kJ/mol
De posse desses valores, calculando corretamente o ΔH, em kJ/mol, deverá encontrar valor igual a:
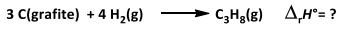
Observe as reações a seguir:
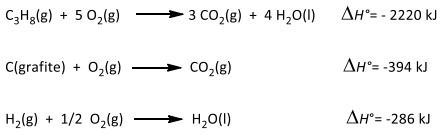
De acordo com as reações acima e os dados fornecidos, o valor da entalpia padrão de formação do gás propano, em quilojoules, é igual a:
Reação de combustão do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2 O(g) ΔH = - 890,4 kJ/mol
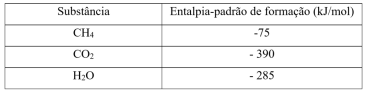
A entalpia-padrão de combustão do metano, em kJ/mol, corresponde a:
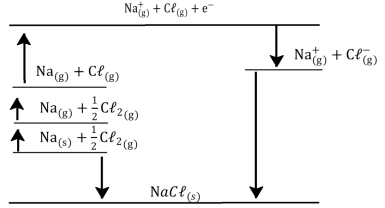
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é:
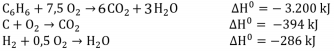
Conclui-se que o ΔH de formação do benzeno é:
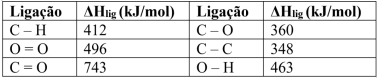
Sabendo que o etanol é vaporizado (ΔHvap = 43,5 kJ/mol) no motor de combustão antes da sua reação com o oxigênio, a entalpia de combustão do etanol líquido é:
Pode-se afirmar que na combustão de 52 g de ácido acético, há: (Dados em g/mol: C = 12, H = 1, O = 16)
A temperatura da água aumenta com a dissolução de NaCl.
- Combustão completa: C(s) + O2(g) ➝ CO2(g) , ∆H1
- Combustão incompleta: C(s) + 1/2 O2(g) ➝ CO(g) , ∆H2
Responda a alternativa correta.
Levando em conta o comportamento energético da reação da questão anterior, marque a alternativa correta:
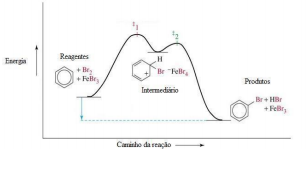
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Um processo endotérmico ocorre com absorção de calor
(ΔH < 0), como, por exemplo, no processo de
congelamento da água. Um processo exotérmico ocorre
com liberação de calor (ΔH > 0), como, por exemplo, no
processo de vaporização da água.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Quando uma reação química se realiza à pressão
constante, a quantidade de calor liberado ou absorvido
é expressa pela variação da entalpia do sistema. Seu
sinal algébrico indica se a reação é endotérmica ou
exotérmica.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Grande parte dos processos químicos é conduzida à
pressão constante ou quase constante. Com isso, o calor
absorvido em uma reação é igual à soma do aumento na
energia do sistema com qualquer trabalho realizado
sobre o sistema.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
A quantidade de calor que é absorvida ou liberada por
um sistema durante uma variação independe de como a
variação ocorre.