Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 366 questões
Sabendo-se que os calores de formação da sacarose, do dióxido de carbono e da água são, respectivamente, 531 kcal/mol, 94 kcal/mol e 68,4 kcal/mol, o resultado obtido pelo perito foi de cerca de:
Sabendo-se que ΔHfo(H2O,L) = -285 kJ/mol, e que ΔHfo(Fe2O3,s) = -824 kJ/mol, o profissional determinou o calor de formação solicitado como sendo de aproximadamente:
Por exemplo, em um processo adiabático, o fluxo de calor durante a mudança de estado é nulo, ao passo que:
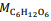 = 180 g/mol e
= 180 g/mol e 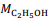 = 46 g/mol.
= 46 g/mol. De acordo com os experimentos de Faraday, a quantidade de produto formado ou de reagente consumido em uma reação eletrolítica é estequiometricamente proporcional à diferença de potencial aplicada entre os eletrodos da célula eletrolítica.
luz e clorofila 6 H2O (I) + 6 CO2 (g) → C6H12O6 (aq) + O2 (g)
Sobre essa reação química, é correto afirmar:
1- Pilha seca comum
( ) Não forma amônia como camada isolante.
2- Pilha alcalina
( ) Sua semirreação catódica é:
2 Ni(OH)3 (s) + 2e → 2 Ni(OH)2 (s) + 2 OH– (aq)
3- Pilha de mercúrio
( ) Emprega sais dissolvidos em solventes não aquosos.
4- Bateria de hidreto metálico
( ) Contém pasta úmida de ZnCl2, NH4Cl e H2O.
5- Bateria de íons lítio
( ) É adequada para dispositivos sensíveis, como aparelhos desurdez, instrumentos científicos e relógios.
Assinale a sequência correta.
Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
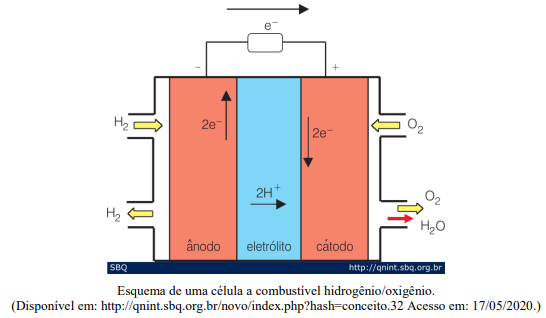
Levando em consideração o funcionamento de uma célula a combustível esquematizado acima, marque V para as afirmativas verdadeiras e F para as falsas.
( ) As células a combustível são células galvânicas nas quais a energia de Gibbs de uma reação química é transformada em energia elétrica (por meio da geração de uma corrente). ( ) A principal semelhança em relação às pilhas e baterias é o fato de, nas células a combustível, os reagentes já estarem armazenados no interior do sistema. ( ) Devido à dificuldade de se armazenar H2, uma alternativa para alimentação das células a combustível é o metanol, que, por sua vez, apresenta a desvantagem de gerar CO e/ou CO2 que são gases de efeito estufa. ( ) O combustível é reduzido de forma contínua no ânodo, enquanto oxigênio é oxidado no cátodo, produzindo água como produto final e energia elétrica.
Assinale a sequência correta.
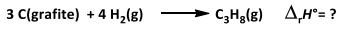
Observe as reações a seguir:
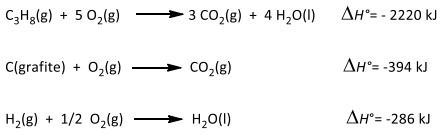
De acordo com as reações acima e os dados fornecidos, o valor da entalpia padrão de formação do gás propano, em quilojoules, é igual a:
O alumínio já foi o metal mais caro do mundo. Por isso, Napoleão disponibilizava talheres e pratos de alumínio para convidados especiais nos banquetes, enquanto os menos favorecidos usavam de ouro. Em 1855, o norte-americano Charles Martin Hall e o francês Paul Louis Toussaint Héroult descobriram e patentearam quase simultaneamente um processo de obtenção de alumínio a partir do minério bauxita, rico em óxido de alumínio.
KEAN, Sam. A colher que desaparece: Editora Zahar, 2011 (adaptado).O processo ficou conhecido como Hall-Heróult e permitiu o estabelecimento da indústria global do alumínio, cuja obtenção ocorre por meio de:
“A maior ameaça à camada de ozônio no século XXI é o gás hilariante (N2O - óxido nitroso). Segundo o Pnuma (Programa das Nações Unidas para o Meio Ambiente), análises de cientistas de 35 organizações revelaram que o N2O, agora, é o gás mais importante a exaurir o ozônio e o terceiro mais poderoso gás do aquecimento global emitido na atmosfera. Os níveis de N2O aumentaram nas últimas décadas, puxados sobretudo pelos processos de nitrificação e de desnitrificação dos fertilizantes nitrogenados no solo.”
Disponível em: <https://www.terra.com.br/noticias/ciencia/clima/onu-faz-soaroxido-nitroso-a-camada-de-VgnCLD2000000dc6eb0aRCRD.html>. Acesso em: 24 nov. 2020.
O mecanismo de destruição pode ser resumido pelas seguintes equações:
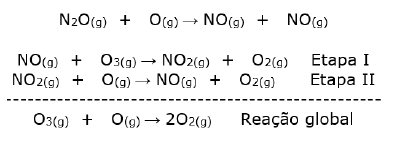
A classificação química do óxido nitroso e a função do NO no mecanismo de destruição do ozônio são, respectivamente:
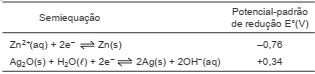
A pilha de zinco e óxido de prata é usada em aparelhos auditivos e relógios de pulso e são menos poluentes do que a de zinco e óxido de mercúrio.
Tendo em vista essas informações e os dados da tabela de
potencial-padrão de redução para as semiequações que
ocorrem nessa pilha, é correto afirmar:
Reação de combustão do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2 O(g) ΔH = - 890,4 kJ/mol
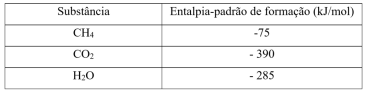
A entalpia-padrão de combustão do metano, em kJ/mol, corresponde a:
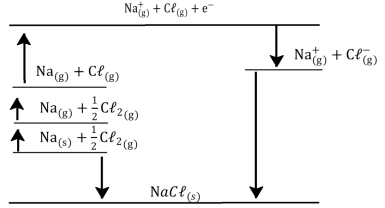
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é:
A partir da 2ª Lei da Termodinâmica o conceito
de entropia foi criado, a fim de explicar a direção de
um processo ou transformação. Sendo assim, a
entropia total é uma medida de desordem que:
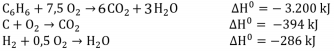
Conclui-se que o ΔH de formação do benzeno é:

A pilha que apresenta maior diferença de potencial padrão pode ser representada esquematicamente por: