Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 1.182 questões
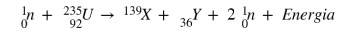
Na reação apresentada, o número atômico de X e o número de massa de Y são, respectivamente,
O alumínio é comumente encontrado na natureza formando minerais, como a criolita (Na3AℓF6). Esse mineral apresenta brilho vítreo e sua cor varia de incolor a branco.
Um processo industrial que utiliza a eletrólise ígnea da criolita, usa uma carga de 1 x 106 Faradays.
Nesse processo, a quantidade de alumínio metálico produzido corresponde, aproximadamente, a
Dados: 1F = 96500C, Massa molar Aℓ = 27 g.mol–1
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é
Considerando que a meia-vida desse radioisótopo é de 13,0 horas, a quantidade que sofreu desintegração, após 2 dias e 4 horas, de uma amostra com 12,00mg de acetato de cobre(II) será, aproximadamente, de
Dados: E0(Zn2+/ Zn) = – 0,76V E0(Cu2+/ Cu) = + 0,34V
Nessa pilha, formada por zinco e cobre, temos
I. 2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
A0│A+n ║ B+n│B0
em que A0 e B0 são as espécies A e B reduzidas, A+n e B+n são as espécies A e B oxidadas, o símbolo │ corresponde à interface metal/solução, e a representação ║ é a ponte salina.
Considerando que pilhas com celas separadas necessitam de uma ponte salina para funcionar, a função dessa ponte salina no conjunto é de:
Admitindo-se que essas espécies possam estar participando do processo responsável pelo acendimento do LED, que opera entre 1,5 e 2,7 V, a possível pilha formada envolve:
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
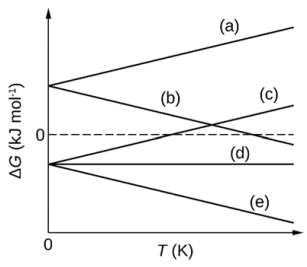
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
A tabela a seguir apresenta os valores de energias das ligações:
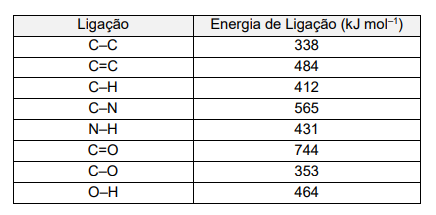
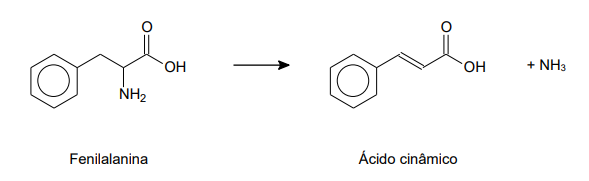
Utilizando os valores das energias das ligações fornecidos, a variação de entalpia envolvida na transformação da fenilalanina em ácido cinâmico representada, em kJ mol-1 , corresponde a:
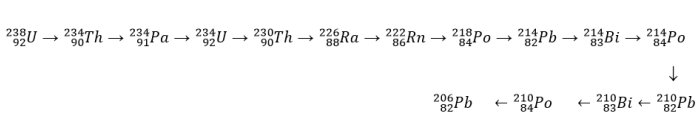
Nessa série radioativa de decaimento, a quantidade de partículas emitidas foi de:
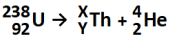
Considerando o exposto, os valores de X e Y (relativos ao tório) são, respectivamente:
Se a ANM se comportar como um vaso perfeitamente adiabático, não ocorrerá trocas de calor entre ela e o meio externo.
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Em uma soldagem com eletrodo revestido, o elevado ponto
de fusão do tungstênio permite a aplicação desse metal como
eletrodo não consumível.