Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 1.182 questões
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Suponha que em um cilindro provido de um pistão móvel sem atrito seja realizada a combustão completa de determinada quantidade de etanol líquido, conforme equação química a seguir, em um processo isotérmico e isobárico em que os gases presentes se comportam idealmente e o volume da fase líquida é constante.
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l)
Do ponto de vista termodinâmico, nesse processo, o(a)
Considere as equações químicas a seguir.
I NH3 + H2O ⇌ NH4+ + OH−
II Cu2+ + 4 NH3 ⇌ [Cu(NH3)4] 2+
III 2 Fe3+ + Sn2+ ⇌ 2 Fe2+ + Sn4+
Ocorre reação de oxirredução apenas na(s) equação(ões)
No que se refere aos processos de corrosão, julgue o item a seguir.
Zinco e magnésio são frequentemente utilizados como
anodos de sacrifício em métodos de proteção galvânica em
ferro, por possuírem maior potencial eletroquímico.
No que se refere aos processos de corrosão, julgue o item a seguir.
A corrosão galvânica consiste na remoção de elétrons do
catodo na presença de um material com potencial de eletrodo
maior.
A respeito de equilíbrio de fases, julgue o item seguinte.
Em um diagrama de fases, o ponto crítico representa a
condição de determinada temperatura e pressão, a partir das
quais não é mais possível formar a fase líquida por
aquecimento e pressurização.
Segundo a Primeira Lei da Termodinâmica, que se refere à conservação da energia, Δu = t, em que Δu é a variação da energia e t é o trabalho realizado.
O teorema da equivalência do trabalho com a energia mecânica é um conceito importante em mecânica, mas que não tem relevância na termodinâmica.
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Conforme a Segunda Lei da Termodinâmica, para
fenômenos macroscópicos ou microscópicos, a entropia
sempre aumenta ou permanece a mesma.
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
No Sistema Internacional de Unidades (SI), a unidade de
calor é o joule, representado pela letra J, sendo 1 J
equivalente a 1 kgf∙m (isto é, 1 quilograma-força
multiplicado pelo metro).
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Entre os mecanismos de transmissão de calor, o único que
pode ocorrer no espaço vazio é a radiação, que consiste em
ondas eletromagnéticas que se propagam na velocidade da
luz.
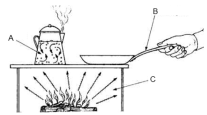
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Na situação ilustrada na figura a seguir, as letras A, B e C indicam, respectivamente, os fenômenos de condução, de convecção e de radiação.
N2O4(g): + 9,16 kJ/mol NO2(g): + 33,18 kJ/mol NO(g): + 90,25 kJ/mol
Com base somente nessas informações, considere as afirmações abaixo.
I - A combustão do nitrogênio é endotérmica.
II - A formação de NO só é espontânea a altas temperaturas.
III- A constante de equilíbrio para a reação de formação do N2O4(g) é negativa.
IV - A constante de equilíbrio para a reação de formação do NO2(g) é pequena.
Quais estão corretas?
A corrosão de metais pode ser definida como o ataque eletroquímico destrutivo e não intencional que geralmente se inicia na superfície. O problema da corrosão metálica é de grande proporção no âmbito econômico, sendo estimado aproximadamente 5% das receitas de uma nação industrializada sejam gastos na prevenção deste processo e na manutenção ou substituição de produtos perdidos ou contaminados, resultado de reações corrosivas.
(Fonte: CALLISTER, W; RETHWISCH, D. Ciência e Engenharia de Materiais Uma Introdução. 8 ed, Rio de Janeiro, LTC, 2012 Com adaptado).
Em relação à corrosão galvânica, existem várias medidas que podem ser adotadas para diminuir seus efeitos. Uma dessas medidas é:
Os principais meios corrosivos de materiais são os mecanismos químico e eletroquimico. No processo de corrosão eletroquímica, ocorre um fluxo de elétrons, que se desloca de uma área da superfície metálica para a outra. A diferença de potencial de natureza eletroquimica, se estabelece entre as regiões que envolvem transferência desses elétrons. As reações na corrosão eletroquimica são anódicas e catódicas (oxidação e redução). Assim, é correto afirmar que:
No experimento descrito a seguir sobre física térmica, o objetivo é avaliar que tal como os líquidos, os gases também sofrem expansão e contração.
Dessa forma, complete corretamente a frase a seguir:
Num recipiente de 500 mL de água quente e em outro a mesma quantidade de água fria, limpe a garrafa e deixe-a secar. No procedimento, pegar uma bexiga e envolver no gargalo da garrafa. Em seguida, colocar a garrafa dentro do recipiente com água quente. Observar que a bexiga após aproximadamente 25 segundos estará _______________. Em seguida, colocar a garrafa dentro do recipiente com água fria e verificar que a bexiga irá _______________.
Após análise, assinale a alternativa CORRETA que complete a frase citada acima:
Observe a imagem.
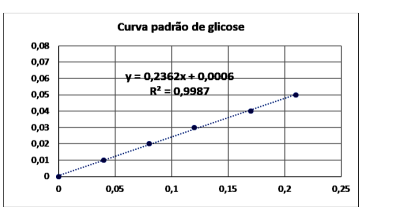
Dentre esses valores de absorbância obtidos, o que pode ser relacionado a concentração de 0,23 mg/mL é
Observe o diagrama de energia a seguir.
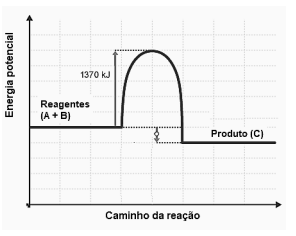
O diagrama se refere a uma reação do tipo
I - Realizarem-se, necessariamente, na presença de água líquida.
II - Realizarem-se em temperaturas, acima do ponto de orvalho.
III - Realizarem-se devido à formação de pilhas de corrosão ou células eletroquímicas.
Está correto o que se afirma em:
