Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 1.182 questões
As bactérias redutoras de sulfato (BRS) têm grande importância na biocorrosão. Embora, até o momento não exista a determinação de um mecanismo único de corrosão ocasionado pela ação das BRS, Kuhr e Vlug (1934) propuseram um mecanismo no qual essas bactérias utilizam o hidrogênio proveniente do consumo realizado pela hidrogenase, catalisando a ativação reversível de hidrogênio. Em condições anaeróbicas, essa reação de corrosão é a evolução de hidrogênio pela dissociação da água, em que os íons de hidrogênio produzidos se encontram adsorvidos sobre a superfície metálica, sendo posteriormente consumidos pelo processo metabólico, como mostra a figura abaixo:
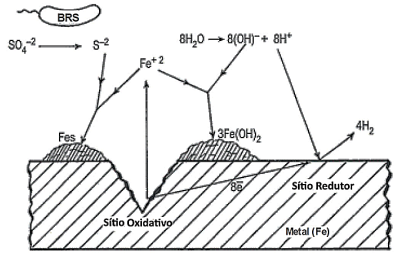
De acordo com o que mostra a figura e a descrição do mecanismo de corrosão supracitado, esse tipo de biocorrosão é classificado como
As duas primeiras formas caracterizam
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Potencial de eletrodo é a medida do potencial individual de
um eletrodo reversível no estado-padrão, ou seja, solutos em
concentração de 1 mol/kg e gases à pressão de 1 bar, ambos
a 273 K.
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Para determinar a capacidade de um metal em atuar como anodo de sacrifício, é adequado montar um eletrodo com o referido metal, com potencial desconhecido, ligá-lo a um eletrodo de potencial conhecido e medir a diferença de potencial entre os eletrodos. Nesse contexto, pode-se usar, para a avaliação, um eletrodo de zinco metálico (Zn), que, em uma célula eletroquímica com solução 1 mol/L de ZnSO4, apresenta a seguinte semirreação no anodo.
Zn (s) → Zn2+ (aq) + 2 e−
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
A equação de Nernst tem por finalidade prever o potencial
de uma pilha durante o seu funcionamento, correlacionando
a variação do potencial da pilha em certo instante da reação
com a variação das concentrações de produtos e reagentes.
Tendo como referência o ensaio acima descrito e considerando os usos da gasolina, julgue o item que se segue.
A gasolina é bastante utilizada em geradores elétricos, os
quais produzem força eletromotriz que é totalmente
convertida em energia elétrica.
Uma corrente elétrica que percorre um condutor gera, em torno desse condutor, um campo magnético com direção determinada pela regra da mão esquerda.