Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.416 questões
(_88^226)Ra-> (_86^222)Rn+(_2^4)α
Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0 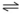 Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+ 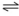 Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
A quantidade de matéria orgânica em águas superficiais e residuais pode ser expressa por meio da demanda química de oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em águas pode ser representada como:
matéria orgânica + (Cr2O7 )2- + H+ ⇄ 2 Cr3+ + CO2 + H2O
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2 .
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formar CO2 .
Está correto o que se afirma em
O professor propôs, como introdução ao estudo das reações de oxirredução, um experimento bem simples para que o aluno tenha condições de observar um fenômeno que envolve mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de vitamina C não efervescente a uma solução de iodo (farmacêutica) e adicionar água. Nessa reação a vitamina C que é oxidada promove um descoramento da solução de iodo que é reduzido.
A transformação que ocorre no iodo pode ser codificada em uma linguagem química como
No estudo de Termoquímica, o professor propôs uma experiência para determinação do calor de combustão do álcool etílico (etanol).
O procedimento experimental e as anotações de um grupo de alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma proveta e transferir para o erlenmeyer. Envolver as paredes do erlenmeyer com jornal e prender com fita crepe. Colocar em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor. Valor anotado Ti = 25°C; VI. acender a lamparina e aquecer a água do erlenmeyer, durante 5 minutos. Após esse tempo, apagar a lamparina e medir a temperatura da água (Tf) e anotar o valor. Valor anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema “álcool-lamparina”(mf) após a combustão. Valor anotado mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1 .°C –1 como calor específico da água e a constante 0,2 cal.g–1 .°C –1 como calor específico do vidro, os alunos devem chegar a um valor para o calor de combustão do álcool, em cal.g–1 , de