Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 1.723 questões
Considere que 2 mols de um gás ideal A são misturados com 3 mols de outro gás ideal B, sem haver nenhuma reação química. Após ser alcançado o equilíbrio, o recipiente possui uma pressão interna de 2 atm. Com base nessas informações, é correto afirmar que são as pressões parciais dos gases A e B no equilíbrio são
Foram colocados 7 g de gás N2 e 8 g de gás O2 em um recipiente vazio rígido de 2 litros, a uma temperatura constante de 127 oC.
Tendo em vista que pV = nRT, TK=TC 273, R = 0,082 K molatm L, N = 14 g/mol, O = 16 g/mol ,݈assinale a alternativa que apresenta a pressão interna desse recipiente, em atmosferas.
Considerando a densidade da água d = 1g/mL, o número de Avogadro ܰNA = 6 ⋅ 1023, massas atômicas do Hidrogênio e Oxigênio iguais, respectivamente, a 1 e 16 u, assinale a alternativa que indica quantos átomos de Hidrogênio há em 9,0 mL de água líquida, à temperatura ambiente.
O Fósforo aparece de quatro formas alotrópicas, como Fósforo branco, vermelho, preto e violeta. Cada um desses tipos básicos origina diferentes estruturas cristalinas, e isso ocasiona diferenças muito grandes nas propriedades físicas e na reatividade. Em relação a essas formas alotrópicas do Fósforo, assinale a alternativa correta.
Sobre o primeiro modelo atômico de Dalton, é INCORRETO afirmar que:
Em relação à equação não balanceada a seguir, que representa o processo de obtenção de ferro a partir do óxido de ferro III presente no minério hematita, são feitas as seguintes afirmações:
Fe2O3 (s) + C (s) → Fe (s) + CO (g)
Dados: volume molar gasoso nas Condições Normais de Temperatura e Pressão (CNTP) = 22,4 L mol-1 constante de Avogadro = 6,0 x 1023 mol-1
I – A partir de 25 mol de óxido de ferro III e 960,0 g de carbono, podem ser obtidos 4,50 x 1025 moléculas de monóxido de carbono, considerando-se rendimento de 100% na reação.
II – O estabelecimento da ligação química entre um átomo de ferro e um átomo de oxigênio, no óxido de ferro III, ocorre através de uma ligação covalente polar.
III – A partir de 200,0 kg de hematita com 80% de pureza em relação ao óxido de ferro III, e quantidade suficiente de carbono, podem ser obtidos 67200 L de monóxido de carbono nas CNTP, considerando-se rendimento de 100% na reação.
IV – O monóxido de carbono apresenta geometria linear e é classificado como um óxido anfótero.
V – A obtenção de 130 mol de ferro, a partir de 100 mol de óxido de ferro III e quantidade suficiente de carbono, representaria um rendimento da reação de 65%.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva as questões 35 e 36:
“Catalisadores são ferramentas fundamentais para os químicos, mas os pesquisadores acreditaram por muito tempo que havia, em princípio, somente dois tipos de catalisadores disponíveis: metais e enzimas. Benjamin List e David MacMillan foram agraciados com o Prêmio Nobel de Química de 2021 porque ambos, em 2000, de forma independente, desenvolveram um terceiro tipo de catálise. Ela é chamada organocatálise assimétrica e se baseia em pequenas moléculas orgânicas. (...)
Catalisadores orgânicos têm uma estrutura estável de átomos de carbono, à qual podem ser inseridos grupos químicos mais ativos. Eles frequentemente possuem elementos comuns como oxigênio, nitrogênio, enxofre ou fósforo. (...)
A rápida expansão no uso de catalisadores orgânicos se deve principalmente a sua capacidade de conduzir catálise assimétrica. Quando moléculas estão sendo sintetizadas, geralmente ocorrem situações nas quais duas moléculas diferentes podem ser formadas, em que – assim como nossas mãos – uma é a imagem ao espelho da outra. Os químicos normalmente desejam apenas uma delas, particularmente na produção de fármacos. (...)”
Adaptado de: https://www.nobelprize.org/prizes/chemistry/2021/press-release/. Acesso em 15 Fev 22.
Assinale a alternativa que apresenta as palavras que completam, correta e respectivamente, a seguinte frase:
Quando duas moléculas diferentes são imagens espelhadas não sobreponíveis uma da outra, estas moléculas são consideradas __________; a condição para a ocorrência desta situação é que as moléculas sejam __________.
• Dados: (p = prótons, e = elétrons e n = nêutrons)
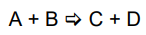
Observe a figura abaixo.
O modelo construído e proposto da figura agrupa os elementos químicos conhecidos e suas
propriedades e está organizado em ordem crescente de
Com base nessas informações, julgue o próximo item.
A degradação do ozônio é uma reação de dissociação.
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua
camada de valência.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação
semimetais.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
A eletronegatividade é a quantidade de energia envolvida no
processo em que o átomo isolado em seu estado fundamental
recebe um elétron.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
Não procede a concepção reducionista da alquimia como práticas da Idade Média e do Renascimento que buscavam a transformação de metais menos nobres em ouro. Da mesma forma, não se pode simplificar dizendo-se que a transição da alquimia à química corresponde à ascensão da primeira em ciência. A alquimia, segundo algumas concepções, não pode ser considerada a origem da química, pois se restringia muito a concepções filosóficas da vida.
Internet:<http://www.qnesc.sbq.org.br/> (com adaptações).
Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se
à atual transmutação dos elementos, como, por exemplo,
aquela que ocorre na síntese dos elementos com número
atômico maior que o do urânio na tabela periódica.