Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 531 questões
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Acerca da entropia da reação, analise as asserções a seguir:
O valor negativo de ΔS indica que um mol de H+(aq) mais um mol de Cl-(q) são menos desordenados que um mol de HCl gasoso separado do solvente água.
PORQUE
Os íons aquosos são mais desordenados que compostos no estado gasoso.
Referente às asserções, é correto afirmar que
O modelo para o átomo proposto por Rutherford está representado a seguir:
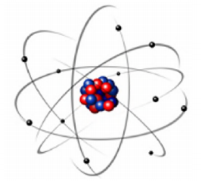
Com esse modelo, Rutherford interpretou
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
A reação representada na equação abaixo é lenta e reversível, mas seu rendimento é melhorado com a adição de quantidades catalíticas de ácido sulfúrico.
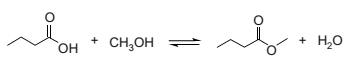
Nessa reação,
Observe a tabela a seguir.
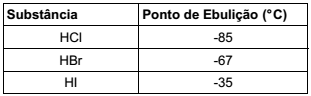
Forças intermoleculares mais fortes levam a pontos de ebulição mais altos, quando se aumentam os momentos dipolo e a
energia de interação dipolo-dipolo. No entanto, tal fator não é
observado nas substâncias apresentadas na tabela. A explicação para isso reside no fato de que
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Os elementos metálicos caracterizam-se por apresentarem
elevadas afinidade eletrônica e energia de ionização.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Com exceção do hélio, os gases nobres possuem oito elétrons
de valência e, por esse motivo, não são capazes de
compartilhar elétrons para formar ligações covalentes.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem
definidas para os elétrons de um átomo, conforme ilustrado
na figura, mostrou-se, mais tarde, ser um equívoco, visto que
os elétrons apresentam propriedades de ondas e, portanto,
não podem ser descritos como partículas com trajetórias
bem definidas.
