Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 1.723 questões
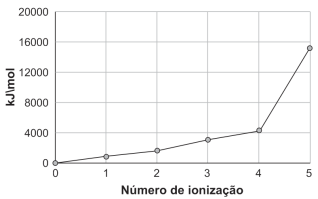
De acordo com as informações, o elemento X é o
Apenas uma pequena parte dos elementos da tabela periódica refere-se aos metais, por serem bons condutores de calor e eletricidade, diferentemente dos ametais, que apresentam má condução de eletricidade e calor. A União Internacional de Química Pura e Aplicada (IUPAC) reconhece o grupo de metaloides, distinguindo-os dos metais por causa de suas propriedades eletrônicas.
Durante os anos de 1800 a 1900, os cientistas da época notaram que muitos dos elementos químicos apresentavam propriedades semelhantes entre si. A observação da regularidade periódica das propriedades físicas e químicas dos elementos conhecidos, bem como a necessidade de organizar um grande volume de informações disponíveis, levaram ao desenvolvimento da tabela periódica.
Bohr postulou sobre a estrutura eletrônica de um átomo ao propor que a matéria é formada por átomos, partículas maciças e indivisíveis que não podem ser criadas nem destruídas. Nesse modelo, os átomos preservam sua identidade em todas as transformações, sendo impossível transformar um elemento químico em outro, o que se contrapõe às ideias dos alquimistas.
Como princípios da teoria atômica de Dalton, tem-se que os elétrons se movem ao redor do núcleo em um número limitado de órbitas bem definidas, que são denominadas órbitas estacionárias. Nessa órbita estacionária, o elétron não emite nem absorve energia.
Gases nobres são átomos encontrados combinados na natureza; qualquer outro átomo, dos demais elementos químicos, geralmente é encontrado isolado, podendo formar inúmeros compostos, sendo que as ligações químicas que mantêm os átomos unidos são fundamentalmente de natureza elétrica.
As reações químicas ocorrem em um nível atômico; no entanto, alguns sinais podem ser observados como indicativo da ocorrência de uma transformação química. Algumas evidências que podem ser percebidas pelos sentidos dos seres humanos são a liberação de energia, a liberação de gases e mudanças de cor.
Na origem do conhecimento químico, nas mais diferentes civilizações, há um grande número de tecnologias químicas, como aquelas relacionadas com a cocção, conservação com sal, produção de bebidas, além de extração, produção e tratamento de metais.
A alquimia consiste em um conjunto de práticas científicas padronizadas da Idade Média que buscavam a transformação de metais menos nobres em ouro; a transição das técnicas modernas da teoria científica da alquimia à química é reconhecida como a origem da química moderna.
A história da química pode ser plenamente observada sem se considerar a história da filosofia, da educação, das religiões e das artes, por se tratar de uma ciência distinta das demais em termos do seu desenvolvimento histórico.
A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
A densidade dos gases, em geral, em condições normais
de temperatura e pressão, é menor que a densidade de
líquidos e sólidos.
A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Um gás real comporta-se como um gás ideal quando
submetido à alta pressão e à alta temperatura.
A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Considerando-se que um número de moléculas n de um
gás ideal ocupe um volume de 10 m3
, a certa
temperatura e pressão, é correto afirmar que, caso a sua
pressão inicial seja reduzida pela metade e a
temperatura inicial dobre, o novo volume ocupado por
esse gás, em L, será de 4.104
.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
O íon Fe3+ (ZFe= 26) apresenta a mesma configuração
eletrônica que o íon Mn2+ (ZMn = 25).
( ) A carga nuclear efetiva aumenta da esquerda para a direita em qualquer período da tabela periódica. ( ) Em um grupo, a carga nuclear efetiva que atua sobre os elétrons de valência varia muito menos do que em um período da tabela periódica. ( ) A carga nuclear efetiva diminui ligeiramente de cima para baixo em um grupo da tabela periódica. ( ) A carga nuclear efetiva que atua sobre os elétrons da camada mais externa é maior do que aquela que atua sobre os elétrons internos por causa da blindagem exercida pelos elétrons internos.
Assinale a sequência correta.
O modelo atômico de Dalton foi adequado para explicar satisfatoriamente:
I. as leis ponderais de Lavoisier e Proust.
II. os experimentos de Faraday sobre eletrólise.
III. a radioatividade natural do elemento urânio.
Está correto o que consta APENAS de
Uma anã branca é o que sobra de uma estrela como o Sol após explodir e expulsar suas camadas externas. A atmosfera dessas estrelas contém apenas hidrogênio e hélio. O núcleo remanescente, no entanto, é tão denso que atrai material de planetas e astros próximos. Na atmosfera das anãs brancas já estudadas, os pesquisadores identificaram cálcio, silício e magnésio.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
Os elementos encontrados nas anãs brancas que pertencem ao mesmo grupo da Tabela Periódica são
Nessa situação, o comportamento descrito deve-se