Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
I. A Teoria Atômica de Dalton trouxe o átomo do campo filosófico para uma perspectiva científica. II. A descoberta dos raios catódicos foi fundamental para a conclusão de que a matéria é formada por partículas eletricamente carregadas. III. A estabilidade do modelo atômico de Rutherford poderia ser explicada pelas leis da Física Clássica, mas não pela Física de Planck-Einstein. IV. O efeito fotoelétrico observado por Einstein corroborou a idéia da dualidade onda-partícula dos elétrons.
Estão corretas apenas as afirmativas:
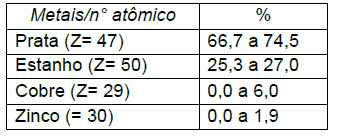
Roberto R. da Silva, et al. A química e a conservação dos dentes, Quím. Nov. na Esc.; N° 13, maio 2001.
Em relação aos metais presentes nas ligas e a tabela periódica é CORRETO a firmar:
Os diversos componentes presentes na água, que alteram seu grau de pureza, podem ser retratados em termos de suas características físicas, químicas e biológicas. Essas características podem ser traduzidas na forma de parâmetros de qualidade da água. Acerca desse assunto, julgue o item seguinte.
Alcalinidade é a concentração de cátions multimetálicos em
solução, como os divalentes Ca2+ e Mg2+.
A respeito dos conceitos relativos à química inorgânica, julgue o seguinte item.
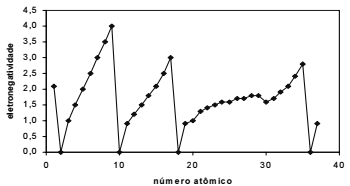
O gráfico abaixo permite concluir que a eletronegatividade é uma propriedade periódica.
I. Pela Lei de Boyel, um gráfico de volume versus pressão é uma parábola. II. O princípio de Avogadro pressupõe a existência de átomos e moléculas e principalmente, que no estado gasoso os átomos ou moléculas de um gás têm um tamanho muito pequeno quando comparados com o volume ocupado pelo conjunto de átomos ou moléculas do gás. Isso implica que o espaço vazio entre as moléculas gasosas deveria ser muito maior que as próprias moléculas. III. A pressão exercida por uma mistura de gases ideais é igual à soma das pressões parciais de cada gás da mistura. A pressão parcial de um gás ideal em uma mistura é definida como a pressão que ele exerceria se ocupasse sozinho o volume ocupado pela mistura na mesma temperatura da mistura.
Observe a reação:
2H2O → 2H2 + O2
Essa reação da água em corrente elétrica é caracterizada
por ser uma reação de
Observe a figura que representa as informações sobre o elemento químico sódio, presente na tabela periódica.
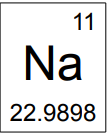
Os números apresentados acima e abaixo do símbolo do
sódio são, respectivamente:

O íon acima representado possui:
T = 19 prótons e 21 nêutrons.
X = 19 prótons e 20 nêutrons.
Y = 20 prótons e 19 nêutrons.
Z = 20 prótons e 20 nêutrons.
Com base nessas afirmações, assinale a alternativa correta.
X: 1s2 Y: 1s2 2s2 2p5 Z: 1s2 2s2 2p6 3s2 3p5
Com relação a esses elementos químicos (X, Y e Z), as seguintes afirmações foram feitas:
1) X apresenta a maior energia de ionização. 2) Y e Z apresentam o mesmo raio atômico. 3) Y e Z pertencem ao mesmo grupo da Tabela Periódica.
Está(ão) correta(s) a(s) afirmativa(s):
A região de Mariana (MG) é reconhecida pela atividade de extração de minério de ferro. No processo, impurezas e substâncias químicas são destinadas a uma barragem de rejeitos, onde ficam retidas e formam uma espécie de lama. Em 2015, com o rompimento da barragem da Samarco, em Mariana, 62 milhões de m3 de dejetos foram despejados provocando o maior desastre ambiental do país: arrasou um ecossistema, matou 13 pessoas, deixou milhares sem casa e continua colocando em risco o organismo da população. A lama tóxica representa grande perigo à saúde das comunidades, pois contém metais pesados como arsênio, mercúrio e chumbo, além de alumínio. (Revista Saúde - Editora Abril, dezembro de 2015, pgs. 50 e 51).
Sobre os metais citados acima, é correto afirmar que:
Leia atentamente os textos 1 e 2: Texto 1: “Em 1869, um professor da Universidade de São Petersburgo, o russo Dmitri Mendeleev (1834–1907), concebeu um diagrama em que ordenava cerca de 60 elementos químicos então conhecidos em função de sua respectiva massa. Essa foi a primeira versão do que viria a ser conhecida como a moderna tabela periódica, hoje composta de 118 elementos, dispostos em 18 grupos (colunas) e 7 períodos (linhas).”
Fonte: Disponível em: https://revistapesquisa.fapesp.br/2019/03/14/a-encruzilhadada-tabela-periodica/. Acesso em 19 jun. 2019). 18
Texto 2:
“Você já ouviu falar do ununênio? Ununênio, ou mesmo Eka-Frâncio, é como se chama, provisoriamente, aquele que será o elemento de número atômico 119 da tabela periódica. Ele se localizará na família dos metais alcalinos, se assemelhando ao lítio, sódio, potássio, rubídio, césio, e frâncio, sendo responsável por iniciar o oitavo período da tabela de Henry Moseley e representado pelo símbolo Uue.”
Fonte: Disponível em: http://www.petquimica.ufc.br/ununenio-um-elemento-aindanao-sintetizado/. Acesso em 19 jun. 2019
Os textos 1 e 2 referem-se à disposição dos elementos químicos inseridos nos
últimos anos na atual Tabela Periódica e mencionam que estes encontram-se,
respectivamente, nos 7º e 8º períodos. Indique a alternativa abaixo que melhor
define os períodos na Tabela Periódica: