Questões de Concurso
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 404 questões
Considere o equilíbrio químico abaixo:
PCl5 (g) ⇋ PCl3(g) + Cl2 (g) ΔH = 87,9 kJ
Sobre a reação acima, analise as assertivas a seguir:
I. A diminuição da temperatura desloca o equilíbrio no sentido dos produtos, favorecendo a formação de PCl3.
II. O aumento da pressão desloca o equilíbrio no sentido dos produtos.
III. A adição de um catalisador aumenta o valor da constante de equilíbrio (Kc) e acelera a reação direta e inversa.
Quais estão corretas?
NO(g) + 2H2(g) → N2(g) + 2 H2O(g)
Considerando os dados apresentados, a lei de velocidade para a reação é:
I. A energia de ativação de uma reação química pode ser reduzida pelo aumento da temperatura do sistema.
II. Reações que ocorrem em uma única etapa (elementares) apresentam velocidades independentes da concentração dos reagentes.
III. A velocidade de uma reação química pode ser influenciada por diversos fatores, tais como: temperatura, uso de catalisador e concentração de reagentes.
Quais estão corretas?
I - C12H22O11 II - MgSO4 III - NaCl IV - Ca3(PO4)2
Quais afirmativas apresentam a maior e a menor temperatura de ebulição, respectivamente?
Ao transferir-se 8,3 mL de HCl P.A. para um balão volumétrico de 500mL, qual a concentração final da solução após diluição com água destilada?
Qual a pressão parcial da água em uma mistura de 180g de água com 154g de tetracloreto de carbono, a 25ºC? (Dados: H = 1 g.mol-1 , C = 12 g.mol-1 ; O = 16 g.mol-1 ; Cl = 35,5 g.mol-1 )
2NO(g) + O2(g) → 2NO2(g)
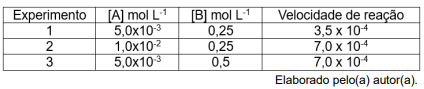
Em uma série de experimentos, foram obtidos os seguintes dados para a velocidade inicial da reação em diferentes concentrações dos reagentes:

Assinale a opção que representa a expressão da lei da velocidade e a ordem global da reação com base nos dados experimentais fornecidos.

Quantos gramas de água são produzidos na oxidação de 6 g de colesterol?
I. A velocidade de uma reação depende da concentração, mas a constante de velocidade não depende dela.
II. Quanto mais baixa for a energia de ativação, mais lenta a reação.
III. Se a velocidade de aparecimento de O2(g), 2 O3(g) → 3 O2(g), é 9 x 10–4 mol/L em determinado instante, a velocidade de desaparecimento do O3(g) é 18 x 10–4 mol/L.
Está correto o que se afirma em
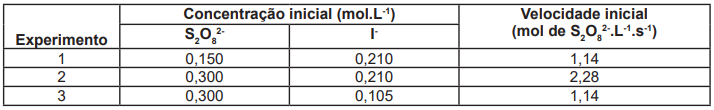
A equação química abaixo representa a síntese do íon triiodeto.
S2 O82- (aq) + 3 I- (aq) → 2 SO42- (aq) + I3 - (aq)
A fim de descobrir a ordem da reação, três experimentos foram realizados, e os resultados encontrados estão na tabela a seguir. Analise os dados da tabela e assinale a alternativa que possui a ordem desta reação.
Use: R = 8,314 J mol-1 K-1 ; ln2 = 0,693
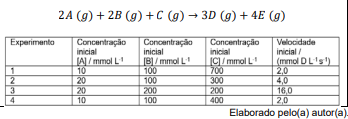
De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:
NH4 + + HNO2 → N2 + 2 H2O + H+
Cujo mecanismo é:
NH4 + → NH3 + H+ (Rápida) HNO2 → H2O + NO+ (Rápida) NO+ + NH3 → NH3NO+ (Lenta) NH3NO+ → N2 + H2O + H+ (Rápida)
Com relação ao exposto, assinale a alternativa que apresenta corretamente a expressão da lei da velocidade diferencial para a reação do HNO2 com NH4 +.
A + A + B
 C + D
C + D A molecularidade dessa reação é: