Questões de Concurso
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 139 questões

As molecularidades das reações I e II são iguais.

A energia do complexo ativado da reação II é maior que a energia do reagente.

A temperatura é o catalisador da reação II.

No mecanismo apresentado, o composto DCE é um intermediário.

O FeCl3 altera a constante da equação de velocidade da reação I.

A velocidade v da reação I é corretamente expressa pela seguinte equação, em que [E] representa a concentração de eteno e t, a variável tempo.

2 H2 (g) + 2 NO (g) → N2 (g) + 2 H2 O (v)
A reação foi repetida três vezes, alterando-se a concentração de um ou de ambos os reagentes e mantendo-se a temperatura constante. Os valores de concentração empregados e os valores de velocidade medidos encontram-se na tabela abaixo:

Observando as regularidades entre as concentrações e as velocidades, a lei de velocidade dessa reação deve ser igual a:
Al(OH)3(s) + 3 HCl(aq) → AlCI3(aq) + 3 H2O(I)
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H 2O(I)
No período de 18 horas, a massa de ácido clorídrico neutralizado em miligramas e a quantidade de moléculas de HCl consumida, na neutralização, foram respectiva e aproximadamente:
Dados: Massas Molares: Mg(OH)2 = 58 g/mol; Al(OH)3 = 78 g/mol; HCl = 36,5 g/mol; Constante de Avogadro = 6,0.1023
“A maior ameaça à camada de ozônio no século XXI é o gás hilariante (N2O - óxido nitroso). Segundo o Pnuma (Programa das Nações Unidas para o Meio Ambiente), análises de cientistas de 35 organizações revelaram que o N2O, agora, é o gás mais importante a exaurir o ozônio e o terceiro mais poderoso gás do aquecimento global emitido na atmosfera. Os níveis de N2O aumentaram nas últimas décadas, puxados sobretudo pelos processos de nitrificação e de desnitrificação dos fertilizantes nitrogenados no solo.”
Disponível em: <https://www.terra.com.br/noticias/ciencia/clima/onu-faz-soaroxido-nitroso-a-camada-de-VgnCLD2000000dc6eb0aRCRD.html>. Acesso em: 24 nov. 2020.
O mecanismo de destruição pode ser resumido pelas seguintes equações:
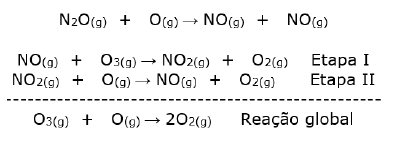
A classificação química do óxido nitroso e a função do NO no mecanismo de destruição do ozônio são, respectivamente:
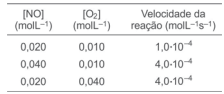
Utilizando-se de experimentos bastante elaborados, os químicos têm investigado o percurso das reações químicas, com o objetivo de determinar a expressão da lei da velocidade e verificar se essas reações são elementares ou não elementares. A tabela apresenta as concentrações colhidas durante três experimentos envolvendo a reação do monóxido de nitrogênio, NO(g), com o oxigênio, O2(g), na obtenção de dióxido de nitrogênio, NO2(g), à determinada temperatura.
A partir da análise dos dados da tabela e das informações
do texto, é correto afirmar que a
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um estudo cinético dessa reação, mediu-se a velocidade da reação em dois experimentos nos quais se variou a concentração inicial de H2O2, conforme apresentado a seguir:
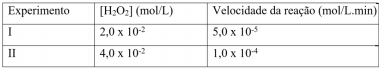
A constante de velocidade dessa reação, em min-1 , é igual a:
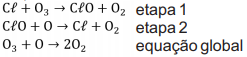
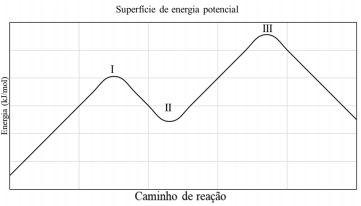
Ao comparar o mecanismo com a SEP, pode-se concluir que a espécie II indicada no diagrama é o:
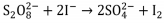
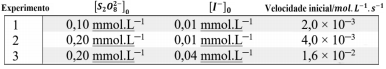
De acordo com a reação química balanceada e os dados experimentais de velocidade, a lei de velocidade experimental é:
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
Na reação do Fe2O3 apresentada, o ácido é o catalisador.
Experimento [NH3] (mol L-1 ) [HNO3] (mol L-1 ) Velocidade da reação (mol L-1 s -1 ) 1 0,02 0,04 2.10-4 2 0,02 0,08 4.10-4 3 0,04 0,04 8.10-4
Baseado nos dados cinéticos, afirma-se:
I- A reação é de ordem 1 para o ácido nítrico. II- A reação é de ordem 2 para a amônia. III- A unidade da constante de velocidade é (mol L-1 ) s-1 .
É correto o que se afirma em:
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

I O aumento da pressão aumentou a velocidade da reação até atingir o limite desse parâmetro, pois, com o aumento da pressão de H2, mais hidrogênio foi dissolvido na solução.
II O aumento da pressão aumentou a velocidade da reação, o que comprova que a reação é de 1.ª ordem em relação ao hidrogênio.
III O fato de haver um limite para o aumento da velocidade da reação devido à pressão indica que existe uma capacidade limitada do catalisador de suportar o H2.
Assinale a opção correta.
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.
