Questões de Concurso
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 294 questões
[Pt(Cl)(dien)]+ (aq) + I- (aq) → [Pt(I)(dien)]+ (aq) + Cl- (aq)
sendo: Dien = dietilenodiamina.
A respeito da troca de ligante Cl- por I- , é correto afirmar que a lei de velocidade dessa reação será de
Considere o diagrama de energia para a reação X + Y → Z.
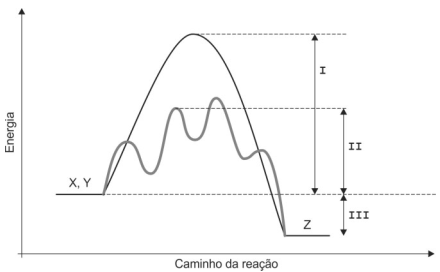
Os intervalos I, II e III representam, correta e respectivamente,
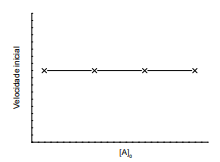
Figura 1. Gráfico da velocidade inicial em função da concentração inicial de A
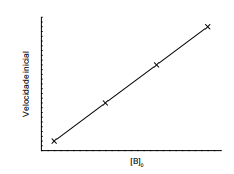
Figura 2. Gráfico da velocidade inicial em função da concentração inicial de B
Com base no procedimento descrito, infere-se que a reação em tela é de ordem
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
Uma reação catalisada para produção de etanol segue o mecanismo a seguir:
Etapa I. 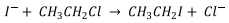
Etapa II. 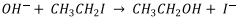
Essa reação de catálise homogênea pode ser representada esquematicamente pelo gráfico abaixo.
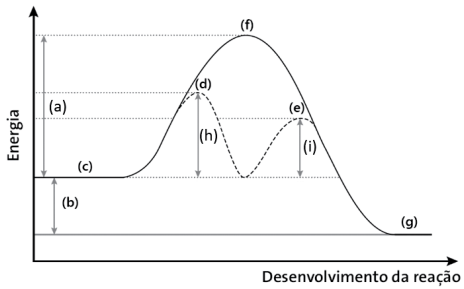
Analise as afirmativas abaixo e assinale a INCORRETA.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
O modelo de Arrhenius considera que a energia de ativação,
a temperatura e a constante universal dos gases perfeitos são
os únicos parâmetros que influenciam a constante cinética de
uma reação.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
Define-se energia de ativação como a barreira energética que
tem de ser suplantada pelos reagentes para iniciar-se uma
reação, a qual será mais rápida quanto maior for a energia de
ativação.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
A energia de ativação para a reação de decomposição do
dióxido de nitrogênio pode ser determinada a partir de um
conjunto de experimentos em que se meça a taxa de reação a
diferentes temperaturas.
Julgue o item a seguir, referentes à cinética química, às leis de velocidade e à equação de Arrhenius.
Um processo elementar é aquele descrito por uma equação
que especifica as quantidades de partículas do reagente e do
produto envolvidas em dada etapa reacional.
A cinética de decomposição do brometo de nitrosila em óxido nítrico e bromo, conforme equação química mostrada a seguir, pode ser expressa pela lei de velocidade d[NOBr]/dt = −kˑ[NOBr]2 , em que [NOBr] representa a concentração de brometo de nitrosila em mol/L; t, o tempo de reação em segundos; e k, a constante cinética do processo.
2 NOBr (g) → 2 NO (g) + Br2 (g)
Sob condições experimentais, em que a constante cinética da reação em apreço vale 2 L ˑ mol−1 ˑ s−1, assinale a opção que corresponde ao tempo de meia vida do processo quando se parte de uma concentração de 0,1 mol/L de brometo de nitrosila.
A respeito de cinética química e cálculo de reatores, julgue o item subsequente.
A energia de ativação em uma reação química contribui para a cinética e para a taxa da reação por meio da equação de arrhenius.
Nesse equacionamento, parâmetros tais como catalise, tamanho de partícula e densidade são negligenciados.
[A] mol.L-1 [B] mol.L-1 Velocidade mol.L-1 .s-1
1 2 4 2 2 4 1 4 8
A ordem da reação é:
[A] mol.L-1 [B] mol.L-1 Velocidade mol.L-1 .s-1
1 2 4 2 2 4 1 4 8
Determine a equação da velocidade.
I - Superfície de contato: Quanto menor a superfície de contato, maior a velocidade da reação.
II - Temperatura: Um aumento na temperatura, geralmente, aumenta a velocidade das reações.
III - Catalisadores: São substâncias químicas capazes de acelerar determinadas reações sem serem consumidas durante o processo.
IV - Concentração dos reagentes: Com a diminuição da concentração dos reagentes há um aumento no número de choques efetivos entre suas partículas constituintes, o que resulta em um aumento da velocidade da reação.
Está correto o que se afirma em:
A2 + B2 → 2 AB
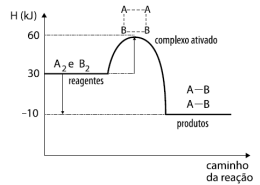
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
I. Ao cortamos a legumes em pequenos pedaços aumentamos a velocidade de cozimento, pois interferimos na energia de ativação da reação.
II. Com o aumento da temperatura, elevamos a agitação térmica das partículas e consequentemente o número de colisões, aumentando a velocidade da reação.
III. A presença de um catalisador altera a entalpia da reação, aumentando a sua velocidade.
IV. Ao mastigarmos mais os alimentos, aumentamos a velocidade da digestão, pois aumentamos a superfície de contato.
Estão corretas as afirmativas:
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
Com relação à termoquímica, à entropia, à espontaneidade de reações e à cinética química, julgue o item.
Um catalisador é uma substância ou espécie que
aumenta a velocidade de uma reação sem ser
consumida, fornecendo um mecanismo alternativo de
baixa energia de ativação para a reação. Um catalisador
é homogêneo quando está na mesma fase dos reagentes
e é heterogêneo se está em uma fase diferente da dos
reagentes.