Questões de Concurso
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 139 questões
A reação química (CH3)3CCl + 2H2O 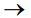 (CH3)3COH +
H3O+
+ Cl-, acontece em três etapas, sendo a primeira a
etapa lenta da reação. O gráfico que representa a
cinética dessa reação química é:
(CH3)3COH +
H3O+
+ Cl-, acontece em três etapas, sendo a primeira a
etapa lenta da reação. O gráfico que representa a
cinética dessa reação química é:
A equação  descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3
h-1, é:
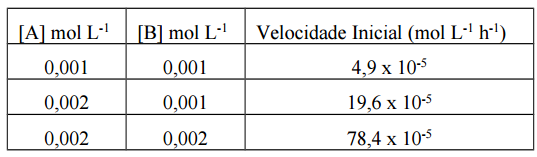
A figura a seguir, adaptada da revista Quim. Nova, v. 38, 1265-1272, 2015, representa o processo de degradação fotocalítica do azul de metileno obtida com uma amostra de CaFe em diferentes condições.
Com base nessa figura, a condição na qual a velocidade inicial
é maior é:
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
Pelo princípio de Le Chatelier, quando uma força é
aplicada a um sistema em equilíbrio dinâmico, o
equilíbrio tende a se ajustar para minimizar o efeito da
força. Um exemplo disso seria o fato de que uma reação
no equilíbrio tende a seguir em uma reação endotérmica
quando se aumenta a temperatura.
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
O equilíbrio químico ocorre quando há um equilíbrio
dinâmico entre reagentes e produtos em uma reação
química, ou seja, a condição na qual os processos direto
e inverso ocorrem simultaneamente em velocidades
iguais.
Acerca da termoquímica, da espontaneidade de reações e da ação de catalisadores, julgue o item a seguir.
Um catalisador é uma substância que aumenta a
velocidade de uma reação sem ser consumida durante
ela. Um catalisador é homogêneo se está presente em
uma fase diferente da dos reagentes e é heterogêneo se
está presente na mesma fase dos reagentes.
Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue o item seguinte.
As reações químicas podem ser reversíveis ou irreversíveis; como exemplo de uma transformação reversível, tem-se a solubilização de comprimidos efervescentes em água com formação de bolhas.A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
Os catalisadores diminuem a quantidade de energia liberada ou
consumida nas reações químicas.
Nitrogênio e Oxigênio são os gases mais abundantes da nossa atmosfera. Em temperaturas ambientes, eles reagem muito pouco, mas, nos motores dos automóveis, trabalhando em temperaturas que podem chegar a cerca de 700⁰C, a reação começa a ser favorável, tornando necessária a presença de catalisadores nos veículos como uma forma de controle da poluição atmosférica.
Observe os dados a seguir:
O valor do Kp para esta reação a 900K é de
A água é uma substância tradicionalmente usada no combate a incêndios por diversas razões. Analise as afirmações a seguir.
I. Ela dificulta o contato entre o combustível e o Oxigênio.
II. Parte da energia liberada na combustão é usada para vaporizar a água, tornando-a indisponível para a combustão.
III. Estando a água em temperatura mais baixa, ela contribui para a diminuição da velocidade global da reação de combustão em andamento.
IV. Água pressurizada empurra o ar para longe do material em combustão.
Assinale a opção que apresenta afirmativas que envolvem fatores cinéticos que explicam a eficiência da água no combate aos incêndios.
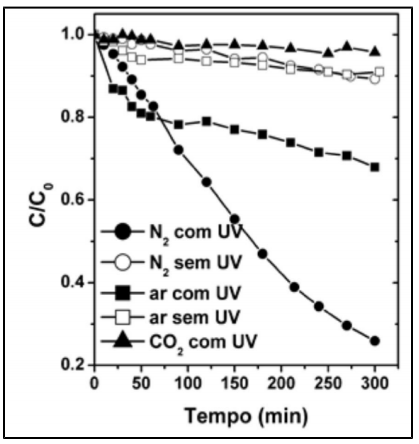
A cinética da reação de brometo de benzila com benzilamina foi estudada por Ravi e colaboradores. Os autores verificaram que a reação é de primeira ordem com respeito a cada reagente.
A reação é esquematizada a seguir:
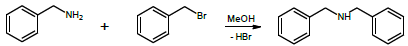
Em um experimento conduzido a 298 K, com excesso de benzilamina, o perfil de decaimento do brometo de benzila foi registrado, sendo apresentado na figura a seguir.
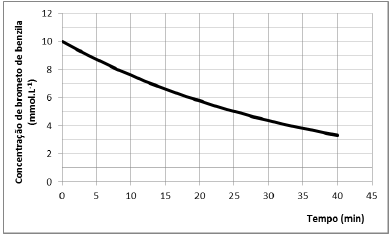
Nessas condições, o tempo (em minutos) em que a concentração
de brometo de benzila terá sido reduzida à 1/8 da concentração
inicial é de
 2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Para a reação de segunda ordem aA + bB → produtos umgráfico de ln [A] versus o tempo é representado por uma reta.
NH4NO3 ? 2N2 + 4H2O + O2
O nitrato de amônio é produzido pela simples neutralização do ácido nítrico, pelo amoníaco segundo a reação:
NH3(g) + HNO3(aq) ? NH4NO3(aq)
Em um estudo sobre a cinética dessa reação foram obtidos os seguintes dados:
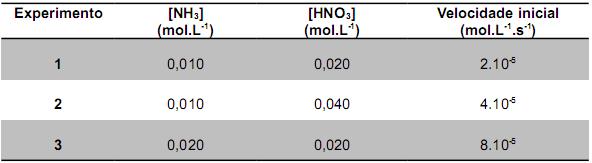
Como base nesses dados cinéticos e na estequiometria da reação, assinale a alternativa CORRETA.
A seguir, julgue as assertivas abaixo:
I - A velocidade média de uma reação é a variação da concentração de uma espécie dividida pelo tempo que leva para que a mudança ocorra.
PORQUE
II - Na velocidade média única, dizem que é a velocidade média dividida pelos coeficientes estequiométricos das espécies monitoradas. Estas técnicas espectroscópicas são muito usadas para estudar as velocidades de reação, em especial nas reações rápidas.
É correto o que se afirma em:
