Questões de Concurso Público Petrobras 2011 para Técnico Químico de Petróleo Júnior
Foram encontradas 60 questões




Considerando as moléculas acima, analise as afirmativas a seguir.
I - 1 e 2 são isômeros cis-trans.
II - 3 e 4 são tautômeros.
III - 5 e 6 são isômeros de posição.
IV - 7 e 8 são isômeros ópticos.
Estão corretas APENAS as afirmativas
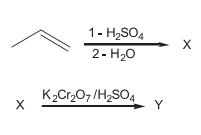
Os produtos X e Y formados nas reações ao lado são, respectivamente,
I - O produto X é um ácido carboxílico.
II - A reação entre a acroleína e o oxigênio é uma redução.
III - O produto Y é o propenoato de metila.
IV - O poli(acrilato de metila) é um polímero de adição.

Está correto APENAS o que se afirma em
I - A separação de substâncias numa mistura é realizada através de um sistema contendo uma fase móvel e outra estacionária.
II - Durante a passagem da fase móvel através da fase estacionária, cada um dos componentes da mistura é retido seletivamente na fase móvel.
III - A cromatografia pode ser utilizada para efetuar não só a separação de espécies químicas como também a identificação e a quantificação.
IV - A cromatografia deriva do grego chroma (cor) e graphe (escrever), logo é uma técnica que só pode ser utilizada para espécies coloridas.
Está correto APENAS o que se afirma em
A corrosão é um fenômeno químico que resulta da ação do meio sobre um determinado material, podendo ser por ação química ou eletroquímica. Não só os materiais metálicos sofrem corrosão. Polímeros como o poli(tereftalato de etileno) (PET) e o concreto também sofrem processos corrosivos. A corrosão dos materiais, os acidentes de transporte e os erros operacionais provocam sérios prejuízos ambientais devido ao vazamento de oleodutos, de tanques de combustíveis, entre outros.

Peças de metal que são enterradas no solo sofrem corrosão eletroquímica com frequência. Alguns exemplos são os oleodutos, gasodutos, tanques de gasolina, entre outros. Graças à proteção catódica, tubulações de aço ficam protegidas da corrosão, utilizando-se, por exemplo, anodos de sacrifício. Conhecendo-se os potenciais padrões de redução de alguns metais (X, Y, Z e W), acima apresentados, quais deles poderiam ser utilizados para evitar a corrosão dessas tubulações?
A corrosão é um fenômeno químico que resulta da ação do meio sobre um determinado material, podendo ser por ação química ou eletroquímica. Não só os materiais metálicos sofrem corrosão. Polímeros como o poli(tereftalato de etileno) (PET) e o concreto também sofrem processos corrosivos. A corrosão dos materiais, os acidentes de transporte e os erros operacionais provocam sérios prejuízos ambientais devido ao vazamento de oleodutos, de tanques de combustíveis, entre outros.

Com relação à corrosão citada, analise as afirmativas a seguir
I - A água sofre redução, enquanto o ferro sofre oxidação.
II - A reação catódica é

III - A diferença de potencial elétrico padrão do processo de corrosão é +0,04 V.
IV - O oxigênio atua como agente redutor.
Está correto APENAS o que se afirma em
Sendo k a constante de velocidade, a lei de velocidade do decaimento radioativo do carbono-14 é representada pela equação
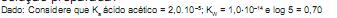
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.
Considere um recipiente de volume conhecido, conforme mostra a figura abaixo. Tal recipiente contém três válvulas (identificadas por Válv. 1, Válv. 2 e Válv. 3) e duas câmaras (nomeadas de P e Q) de medidas idênticas, conectadas por um cilindro. Todas as válvulas estão fechadas e o recipiente se encontra completamente vazio.

Ao se abrir a Válv. 1, admitem-se dois gases na câmara
P: 28 g de nitrogênio e 56 g de but-1-eno. Após a entrada
dessa quantidade dos gases, a Válv. 1 foi fechada. Nesse
momento, a temperatura do sistema era de 300 K, e a
pressão medida do sistema foi de

.
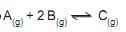 foi determinada em diferentes temperaturas, como mostra a tabela abaixo.
foi determinada em diferentes temperaturas, como mostra a tabela abaixo.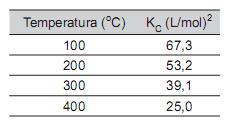
A esse respeito, considere as afirmativas a seguir
I - O aumento da temperatura aumenta a quantidade de produto formada.
II - Trata-se de uma reação com ΔH menor que zero.
III - O aumento da pressão aumenta a quantidade de produto formada.
IV - Na temperatura de 100 °C, o equilíbrio foi alcançado mais rapidamente que a 400 °C.
Estão corretas APENAS as afirmativas
A percentagem de carbonato de cálcio, na amostra de calcário, considerando-se que, nas condições do experimento, o volume molar dos gases é de 25,0 L/mol e as impurezas presentes são inertes, é
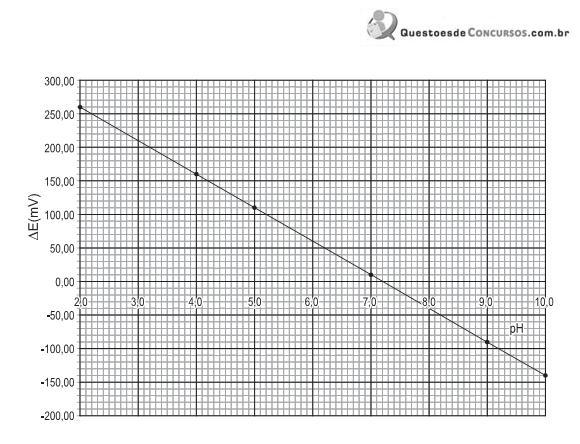
A partir da análise do gráfico, o módulo do fator de resposta, em mV/pH, é
Dado: pF = -log [F- ]
Sobre essa análise potenciométrica, afirma-se que o(a)
