Questões de Concurso Público Petrobras 2011 para Técnico Químico de Petróleo Júnior
Foram encontradas 60 questões
Dados : Constante do ponto de ebulição = 0,52 °C.kg.mol -1
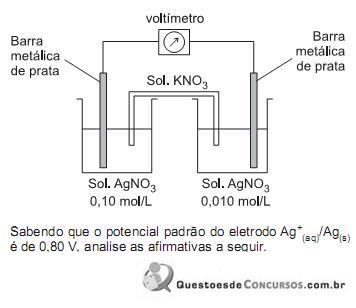
I – A força eletromotriz da pilha registrada pelo voltímetro terá um valor de 1,60 V no início do processo.
II – As concentrações de íons de prata nas duas soluções serão iguais quando o equilíbrio for atingido.
III – O catodo dessa pilha é formado pela barra metálica de prata e a solução de concentração de 0,10 mol/L.
IV – A massa da barra metálica de prata mergulhada na solução de concentração 0,010 mol/L diminuirá até o equilíbrio ser atingido.
Estão corretas APENAS as afirmativas
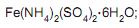 adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de
adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de 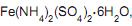 em gramas, utilizada nesse procedimento, foi de
em gramas, utilizada nesse procedimento, foi de
A ordem correta das partes do diagrama de blocos de um espectrofotômetro de absorção atômica representado acima é:
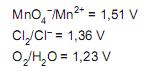
Nas condições padrão, haverá formação de gás pela reação entre
O termo espectroscopia se refere ao estudo da interação da matéria com ondas eletromagnéticas ou, mais amplamente, com fontes de energia, incluindo, também, feixes de partículas como elétrons. O espectro eletromagnético abrange desde ondas de rádio (grandes comprimentos de
onda) até raios X (pequenos comprimentos de onda). entre esses extremos, há a radiação na região do infravermelho (IV), do visível e do ultravioleta (UV). A região da luz visível é uma pequena parte do espectro eletromagnético, que compreende radiações entre, aproximadamente,
400 e 700 nm.
As técnicas espectroscópicas desempenharam um papel central na descoberta de novos elementos e, também, na evolução do conhecimento sobre a estrutura do átomo,
como feito por Niels Bohr, ao estudar os espectros de absorção e emissão dos átomos.
Considerando-se que as transições eletrônicas observadas por Balmer no espectro de absorção partem do segundo nível energético do átomo de hidrogênio, a absorção da radiação de comprimento de onda de 656 nm leva o elétron ao
O termo espectroscopia se refere ao estudo da interação da matéria com ondas eletromagnéticas ou, mais amplamente, com fontes de energia, incluindo, também, feixes de partículas como elétrons. O espectro eletromagnético abrange desde ondas de rádio (grandes comprimentos de
onda) até raios X (pequenos comprimentos de onda). entre esses extremos, há a radiação na região do infravermelho (IV), do visível e do ultravioleta (UV). A região da luz visível é uma pequena parte do espectro eletromagnético, que compreende radiações entre, aproximadamente,
400 e 700 nm.
As técnicas espectroscópicas desempenharam um papel central na descoberta de novos elementos e, também, na evolução do conhecimento sobre a estrutura do átomo,
como feito por Niels Bohr, ao estudar os espectros de absorção e emissão dos átomos.
I – A energia de cada fóton que incidirá na superfície metálica é independente da intensidade da luz.
II – Para que o efeito fotoelétrico seja observado no sódio, necessita-se de um maior comprimento de onda que o utilizado para o potássio.
III – O comprimento de onda necessário para que haja o efeito fotoelétrico aumentará com a dificuldade em ejetar os elétrons.
IV – Para um mesmo elemento, quanto menor o comprimento de onda da luz incidente, maior será a energia cinética do primeiro elétron ejetado.
Estão corretas APENAS as afirmativas

Sobre esses elementos, considere as afirmativas a seguir.
I – A quarta camada do elemento M está completamente preenchida.
II – J, Q e M são metais alcalinos.
III – X é um metal do grupo do carbono.
IV – Q e X são do mesmo período da Tabela Periódica.
Estão corretas APENAS as afirmativas
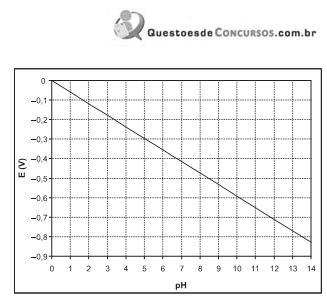
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas
I – O gás hidrogênio é borbulhado continuamente sobre a superfície do eletrodo a uma pressão de 1,00 atm.
II – O potencial de redução do eletrodo padrão de hidrogênio, atribuído por convenção, é zero em qualquer temperatura.
III – O metal condutor (Pt) é reduzido pelo hidrogênio atômico, formando um depósito de platina finamente dividida (negro de platina).
IV – A reação do eletrodo de hidrogênio é irreversível, ocorrendo sempre no sentido da redução.
Estão corretas APENAS as afirmativas
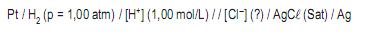
Para diferença de potencial de + 340 mV, determinada em um milivoltímetro eletrônico, a concentração aproximada de cloreto, na amostra de água, em mol/L, é

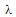 = 500 nm e caminho ótico = 20 mm. Sabendo-se que a absortividade molar desse soluto, em 500 nm, é 5,5 .103 L mol -1 cm-1 , a massa molecular do soluto, em g/mol, é
= 500 nm e caminho ótico = 20 mm. Sabendo-se que a absortividade molar desse soluto, em 500 nm, é 5,5 .103 L mol -1 cm-1 , a massa molecular do soluto, em g/mol, é