Através da equação de Nernst, pode-se calcular a variação do...
Próximas questões
Com base no mesmo assunto
Ano: 2011
Banca:
CESGRANRIO
Órgão:
Petrobras
Prova:
CESGRANRIO - 2011 - Petrobras - Técnico Químico de Petróleo Júnior |
Q182902
Química
Através da equação de Nernst, pode-se calcular a variação do potencial do eletrodo água/gás hidrogênio em função do pH. O gráfico abaixo mostra essa dependência.
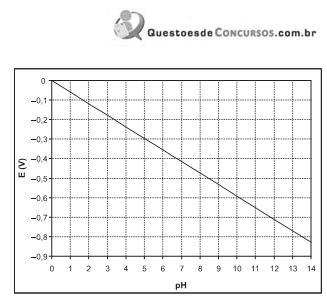
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas

Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas