Questões de Concurso Público Petrobras 2018 para Técnico Químico de Petróleo Júnior
Foram encontradas 38 questões
A radiação eletromagnética na região do infravermelho não é suficientemente energética para promover transições eletrônicas, porém pode produzir transições nos estados vibracionais e rotacionais numa molécula. Considere a influência da radiação no infravermelho nas moléculas de: água, monóxido de carbono e amônia.
Observa-se somente vibração de estiramento APENAS nas moléculas de
O alumínio pode ser determinado por espectrofotometria de absorção após a formação do complexo colorido entre Al3+ e o corante vermelho de alizarina (AZR), que reagem na proporção de 1 para 1, em pH 3. A medição de absorvância foi feita em 480 nm, os valores medidos (já descontados do valor do branco) de quatro diferentes soluções padrões do complexo são mostradas na Tabela abaixo. A curva analítica obtida teve comportamento linear e passou pela origem — ponto (0,0).
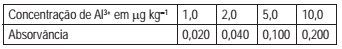
Uma solução de amostra de água de torneira foi analisada pelo método, e a absorvância líquida medida foi 0,070.
A concentração de Al3+, em μg kg-1, na solução de amostra é
Uma solução padrão de um corante foi colocada na cubeta de quartzo (1,00 cm de caminho óptico) de um espectrofotômetro. O percentual de radiação (em 550 nm) transmitida através da solução foi de 10%, valor já corrigido em relação à contribuição do solvente. A absortividade molar, em 550 nm, do corante é 10.000 L mol-1 cm-1 , e o resultado experimental se encontrava na faixa linear regida pela Lei de Beer-Lambert.
A concentração, em mol L-1 , do corante na solução é
Um copo Becher contém uma solução aquosa onde duas substâncias estão dissolvidas. Essa solução foi tratada com um reagente que formou um precipitado ao reagir com uma das substâncias. Todo o material foi transferido para um funil, com membrana, acoplado a um Kitasato conectado a uma torneira por uma trompa. Após filtragem, a solução do Kitassato foi transferida para um placa de Petri, que foi colocada numa estufa a 60°C. Após 24 h, o filme sólido na placa foi raspado e colocado em um frasco âmbar com tampa.
Com base no procedimento descrito, identificam-se quais métodos de separação?
Na determinação de níquel, presente na forma de porfirina de níquel em petróleo, a amostra foi diluída com MIBK (metilisobutilcetona ou, segundo a IUPAC, 4-metil-pentan-2-ona) antes de ser introduzida na chama de um espectrômetro de absorção atômica.
Considere as seguintes ações do analista na realização das análises:
I - usar uma lâmpada de catodo oco de níquel;
II - ajustar o feixe da lâmpada para passar na zona de combustão primária da chama;
III - quantificar usando curva analítica construída com soluções feitas com padrão metalorgânico de níquel dissolvido em MIBK;
IV - ajustar o fator de diluição da amostra em MIBK para que o sinal fique na faixa linear dinâmica da resposta analítica.
A(s) ação(ões) inapropriada(s) para obter um resultado analítico exato é(são) somente a(s)
No procedimento de extração líquido-líquido, em um funil de extração, uma espécie química alvo (analito), dissolvida num solvente (denominado aqui de solvente original), é extraída para outro solvente (denominado aqui de solvente extrator) de diferente polaridade, tirando vantagem de uma partição favorável do analito para o solvente extrator. A constante de partição (Kf ) é dada pela razão entre as concentrações do analito no solvente extrator (Solv-ext) e no solvente original (Solv-orig).
Kf = [analito]Solv-ext. / [analito]Solv-orig.
Os átomos de um determinado elemento químico têm a configuração eletrônica:
[configuração de um gás nobre] 3s2 3p1 .
O gás nobre que tem configuração eletrônica igual à configuração indicada entre colchetes é o
Na espectrometria de absorção atômica com atomização eletrotérmica, o analista controla o aquecimento do atomizador.
Em um programa de aquecimento em etapas e com faixas de temperatura típicas, uma das etapas é a pirólise, cujo objetivo é
A reação representada abaixo é a titulação potenciométrica de Cr2+ com solução padrão de Ce4+, usando um eletrodo indicador de Pt.
Cr2+ + Ce4+ → Cr3+ + Ce3+
Antes do ponto de equivalência, quando a concentração de Cr2+ é 100 vezes maior que a de Cr3+, o potencial medido, em V (numa temperatura T em que RT/F = 0,06 V), é
Dados
Potenciais em relação ao eletrodo padrão de hidrogênio.
Cr3+ + e → Cr2+ Eo = - 0,41 V
Ce4+ + e → Ce3+ Eo
= +1,44 V
Um procedimento gravimétrico foi realizado de acordo com as instruções da literatura. Um precipitado foi obtido após a mistura da solução de amostra com a solução do reagente precipitante (esta última adicionada em quantidade para garantir excesso estequiométrico). Por conta das características do precipitado, uma fração ficou suspensa na solução (suspensão coloidal) e foi perdida na filtragem para recolher o sólido. Após secagem, a massa final do precipitado foi medida em balança calibrada. O procedimento foi repetido três vezes para se obter um valor médio de massa de analito e seu desvio padrão.
Com relação aos erros associados ao resultado, tem-se
A determinação de glicose foi feita em quatro réplicas, isto é, n = 4, em uma amostra coletada em jejum. Os seguintes resultados foram obtidos: 91,0 mg dL-1 ; 95,0 mg dL-1 ; 96,0 mg dL-1 e 98,0 mg dL-1 , com desvio padrão 2,9 mg dL-1 . A distribuição dos dados tende à normalidade (com t = 3,2 para 3 graus de liberdade e com 95% de limite de confiança).
Considerando o valor médio e o intervalo de confiança do resultado, o valor mais próximo, em mg dL-1 , da maior concentração admitida para glicose na amostra é
Um eletrodo é formado por um fio de prata recoberto com uma camada de AgBr(s). A reação de redução característica do eletrodo é representada na equação abaixo.
AgBr(s) + e ⇋ Ag(s) + Br - (aq)
A aplicação desse eletrodo em potenciometria é de
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
O potencial padrão de redução do Fe3+ (ver equação I) é +0,77 V em relação ao eletrodo padrão de hidrogênio (EPH). O eletrodo de referência de calomelano, ou Hg/Hg2Cℓ2 (KCℓsat), tem potencial de redução (ver equação II) igual a +0,24 V em relação ao EPH.
I - Fe3+ (aq) + e → Fe2+ (aq) E° = +0,77 V
II - Hg2Cℓ2(s) + e → 2 Hg(ℓ) + 2 Cℓ- (aq) E° = +0,24 V
Assim sendo, o potencial de redução padrão do Fe3+, em V, em relação ao eletrodo de referência de calomelano é
Uma solução de NaCℓ foi feita dissolvendo, totalmente, 0,100 g do sal em água antes de transferir essa mistura para um balão volumétrico de 100,00 mL onde a solução teve seu volume ajustado. A incerteza da massa de NaCℓ é 0,001 g (calculada considerando duas etapas: a tara e a pesagem propriamente dita do sal), e a incerteza do balão é 0,10 mL.
Assim, essa solução teria uma incerteza de concentração, em gL-1 , de