Questões de Concurso Público ANVISA 2024 para Especialista em Regulação e Vigilância Sanitária - Área 2
Foram encontradas 120 questões
No que concerne às boas práticas de fabricação complementares às atividades de qualificação e validação, julgue o item a seguir.
O relatório de validação é o documento que descreve as
atividades a serem realizadas na validação de um projeto
específico para a aprovação da qualificação de um processo
produtivo e deve definir os parâmetros críticos do
processo (PCP) e os atributos críticos da qualidade (ACQ).
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
A solicitação deve se basear na regulamentação vigente para
o registro de fitoterápicos, ou seja, medicamentos obtidos
empregando-se matérias-primas vegetais.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
No ato do protocolo do pedido de registro, deverão ser
apresentados um plano de farmacovigilância e um plano de
minimização de risco.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
A documentação para a solicitação do registro deve
apresentar os estudos de estabilidade acelerada nas condições
previstas para a zona climática II, que representa o local de
produção do medicamento.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
No ato do protocolo do pedido de registro, deverá ser
apresentado relatório contendo as especificações dos
excipientes utilizados no medicamento em questão, mesmo
que sejam excipientes comumente utilizados em outras
formulações farmacêuticas.
Considerando o caso da detecção de mais de uma nitrosamina no mesmo produto, a soma de todas as nitrosaminas presentes no produto não deve ultrapassar o limite de aceitação referente à nitrosamina menos potente entre as presentes.
Com relação às nitrosaminas e a seus limites de segurança, julgue o item a seguir.
As N-nitrosaminas constituem uma classe de compostos
caracterizados pela ligação de um grupo nitroso (−N=O) a
um grupo funcional amina (−NR2).
No caso de métodos cromatográficos, deve ser comprovada a pureza cromatográfica do sinal do analito, inclusive em amostras biológicas.
Acerca dos métodos analíticos para caracterização e identificação de resíduos e impurezas, julgue o item que se segue.
As soluções utilizadas para avaliação da linearidade de um
método analítico devem ser preparadas de maneira
independente, devendo ser utilizadas soluções diluídas de
uma mesma solução-mãe da solução química de
referência (SQR).
A respeito de reações químicas orgânicas, julgue o próximo item.
Reações exergônicas ocorrem quando a variação de energia
de Gibbs assume um valor negativo, significando que
energia foi absorvida do ambiente durante a reação.
Para o estudo toxicológico em animais, a via de administração e a posologia máxima diária são prescindíveis nos casos de espécies animais com maior sensibilidade aos efeitos da substância recebida.
Quanto à máxima administração diária e aos limites de administração diária estabelecidos para a segurança de impurezas, julgue o item subsequente.
A necessidade de qualificação de determinada impureza
depende da posologia proposta para o produto, mas não deve
ser avaliada no contexto da dose máxima diária que possa ser
administrada.
Um laboratório farmacêutico brasileiro deseja patrocinar um estudo de equivalência farmacêutica a fim de comparar o medicamento genérico candidato ao de referência. Ambos são apresentados na forma de comprimidos simples, contendo 100 mg de um fármaco anti-inflamatório, sendo o comprimido-teste levemente amarelado, de formato oval, e o comprimido comparador branco, de formato circular. A substância ativa possui solubilidade aquosa de 100 µg/mL. Em ensaios preliminares, o medicamento-teste apresentou dissolução média de 85% da substância ativa em até 30 minutos.
Considerando o caso hipotético descrito e os múltiplos aspectos a ele relacionados, julgue o item a seguir.
As apresentações não podem ser consideradas equivalentes
farmacêuticos, pois, para isso, devem possuir a mesma cor
e forma.
Um laboratório farmacêutico brasileiro deseja patrocinar um estudo de equivalência farmacêutica a fim de comparar o medicamento genérico candidato ao de referência. Ambos são apresentados na forma de comprimidos simples, contendo 100 mg de um fármaco anti-inflamatório, sendo o comprimido-teste levemente amarelado, de formato oval, e o comprimido comparador branco, de formato circular. A substância ativa possui solubilidade aquosa de 100 µg/mL. Em ensaios preliminares, o medicamento-teste apresentou dissolução média de 85% da substância ativa em até 30 minutos.
Considerando o caso hipotético descrito e os múltiplos aspectos a ele relacionados, julgue o item a seguir.
Pelo fato de o medicamento-teste apresentar dissolução
muito rápida, o estudo do perfil de dissolução comparativo
não é requisitado para fins de comprovação de equivalência
farmacêutica.
Um laboratório farmacêutico brasileiro deseja patrocinar um estudo de equivalência farmacêutica a fim de comparar o medicamento genérico candidato ao de referência. Ambos são apresentados na forma de comprimidos simples, contendo 100 mg de um fármaco anti-inflamatório, sendo o comprimido-teste levemente amarelado, de formato oval, e o comprimido comparador branco, de formato circular. A substância ativa possui solubilidade aquosa de 100 µg/mL. Em ensaios preliminares, o medicamento-teste apresentou dissolução média de 85% da substância ativa em até 30 minutos.
Considerando o caso hipotético descrito e os múltiplos aspectos a ele relacionados, julgue o item a seguir.
O estudo não precisa incluir análises de variação de peso
médio dos comprimidos, uma vez que a substância ativa é
altamente solúvel.
Um laboratório farmacêutico brasileiro deseja patrocinar um estudo de equivalência farmacêutica a fim de comparar o medicamento genérico candidato ao de referência. Ambos são apresentados na forma de comprimidos simples, contendo 100 mg de um fármaco anti-inflamatório, sendo o comprimido-teste levemente amarelado, de formato oval, e o comprimido comparador branco, de formato circular. A substância ativa possui solubilidade aquosa de 100 µg/mL. Em ensaios preliminares, o medicamento-teste apresentou dissolução média de 85% da substância ativa em até 30 minutos.
Considerando o caso hipotético descrito e os múltiplos aspectos a ele relacionados, julgue o item a seguir.
O estudo de equivalência poderia ser realizado caso um dos
comprimidos, teste ou referência, apresentasse revestimento,
desde que o revestimento não controlasse a liberação da
substância ativa.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.
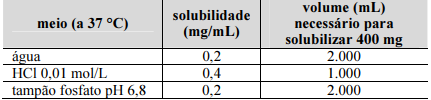
Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
O metronidazol apresenta alta permeabilidade intestinal.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
A forma farmacêutica do medicamento genérico descrito não está incluída da lista de formas farmacêuticas sujeitas à bioisenção
da ANVISA.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
No caso em tela, a bioisenção para as demais dosagens fica condicionada à comprovação da farmacocinética linear.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
De acordo com o sistema de classificação biofarmacêutica (SCB), os medicamentos contendo benzoilmetronidazol devem passar
por estudos de bioequivalência devido à sua baixa solubilidade.